
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
对EGFR酪氨酸激酶抑制剂(EGFR-TKI)的固有耐药(Intrinsic resistance)和获得耐药(acquired resistance)是EGFR突变型非小细胞肺癌(NSCLC)患者治疗失败的主要原因,然而EGFR-TKI的固有耐药性背后的机制在很大程度上仍然未知。
5-甲基胞嘧啶(m5C)是哺乳动物mRNA的重要转录后修饰,其由NOP2/Sun结构域(NSUN)RNA甲基转移酶或DNA甲基转移酶2(DNMT2)催化,并可通过TET甲基胞嘧啶双加氧酶2(TET2)去甲基化。Aly/REF出核因子(ALYREF)识别m5C修饰的mRNA以促进mRNA出核,而Y盒结合蛋白1(YBX1)直接结合m5C甲基化的mRNA以稳定mRNA。m5C异常修饰与膀胱癌、胃癌和食管鳞癌的发病和发展有关。m5C修饰在各种肿瘤的发病机制中起着至关重要的作用,然而RNA m5C修饰在肿瘤耐药性中的作用和分子机制尚不清楚。
2023年05月09日,郑州大学田鑫教授团队、阚全程教授团队与中国科学院北京基因组研究所杨运桂团队合作在《Molecular Cancer》杂志上发表题为“Aberrant m5C hypermethylation mediates intrinsic resistance to gefitinib through NSUN2/YBX1/QSOX1 axis in EGFR-mutant non-small-cell lung cancer”的研究论文,该研究揭示了通过NSUN2-YBX1-QSOX1轴的异常RNA m5C修饰在介导EGFR突变型NSCLC对吉非替尼固有耐药性中的关键功能。

标题:Aberrant m5C hypermethylation mediates intrinsic resistance to gefitinib through NSUN2/YBX1/QSOX1 axis in EGFR-mutant non-small-cell lung cancer(在EGFR突变型非小细胞肺癌中,异常m5C高甲基化通过NSUN2/YBX1/QSOX1轴介导对吉非替尼的固有耐药)
时间:2023.05.09
期刊:Molecular Cancer
影响因子:IF 41.444
技术平台:功能实验、质粒转染、RNA-BS、mRNA-seq、MeRIP-qPCR、Western blot等
样本:人肺腺癌细胞系PC-9、HCC827、HCC2935、HCC4006、H1650、HCC2279、H1975细胞,药物敏感或固有耐药EGFR-TKI的NSCLC患者肺腺癌组织
研究摘要:
该研究通过在非小细胞肺癌(NSCLC)细胞系和患者样本中检测RNA m5C甲基化、m5C writer NOP2/Sun RNA甲基转移酶家族成员2(NSUN2)与EGFR-TKI耐药的相关性。通过体外和体内功能获得实验和功能丧失试验研究了NSUN2对EGFR-TKI耐药性的影响。通过RNA测序(RNA-seq)、亚硫酸盐RNA测序(RNA-BS)和m5C甲基化RNA免疫沉淀qPCR(MeRIP-qPCR)鉴定NSUN2参与EGFR-TKI耐药的靶基因。此外,通过功能拯救实验和嘌呤霉素掺入实验研究了NSUN2对靶基因表达的调控机制。
结果表明,RNA m5C高甲基化和NSUN2与EGFR-TKI的固有耐药性显著相关。NSUN2过表达导致吉非替尼耐药和肿瘤复发,而NSUN2基因抑制导致肿瘤消退,并在体外和体内克服了对吉非替尼的固有耐药性。整合RNA-seq和m5C-BS分析结果,表明QSOX1(quiescin sulfhydryl oxidase 1)是m5C异常修饰的潜在靶点。NSUN2甲基化QSOX1编码序列区域,通过m5C readers Y-box结合蛋白1(YBX1)增强QSOX1翻译。NSUN2-YBX1-QSOX1通路的基因沉默克服了非小细胞肺癌中固有的吉非替尼耐药性。本研究揭示了先前未被识别的NSUN2-YBX1-QSOX1轴信号在对EGFR-TKI固有耐药的NSCLC患者的预后和治疗中的作用。
研究结果:
(1)m5C高甲基化和NSUN2与吉非替尼固有耐药性相关
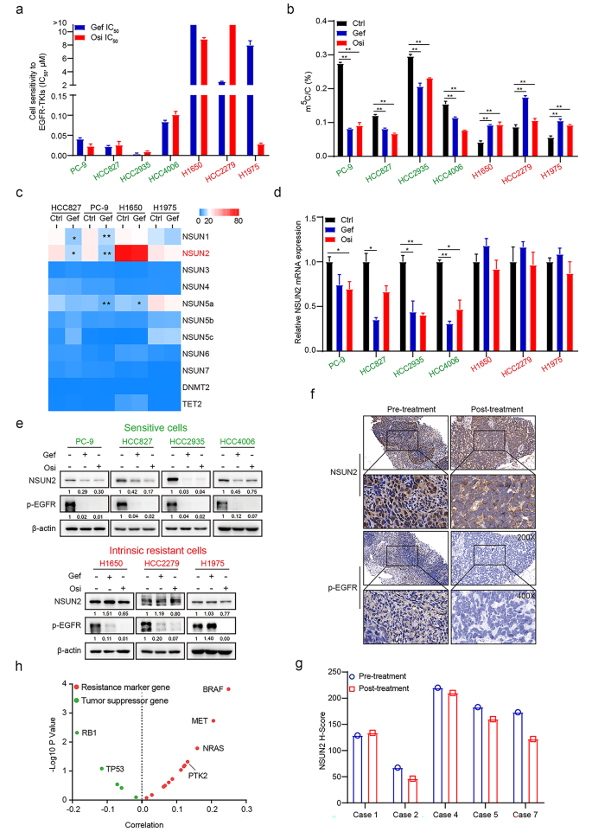
图1:m5C高甲基化和NSUN2稳定表达与NSCLC吉非替尼的固有耐药相关
a. 以梯度浓度的吉非替尼或奥希替尼处理NSCLC细胞72 h,并用CCK-8法检测其IC50值。
b. 用吉非替尼(1µM)或奥希替尼(1µM)处理敏感性和耐药性细胞24 h,ELISA法检测mRNA m5C水平。
c. 吉非替尼(1µM)处理敏感性和耐药性细胞24 h,绘制微阵列分析中RNA m5C甲基化转移酶和去甲基化酶的基因表达热图。
d. 用吉非替尼(1µM)或奥希替尼(1µM)处理敏感性和耐药性细胞24 h, qRT-PCR检测NSUN2 mRNA表达。
e. 用吉非替尼(1µM)或奥希替尼(1µM)处理敏感性和耐药性细胞24 h后,用相应抗体进行western blot分析全细胞裂解物。
f-g. 吉非替尼固有耐药的NSCLC患者NSUN2和p-EGFR的IHC染色代表性图像(f)和治疗前后活检的定量H-scores评分(g)。
h. TCGA-LUAD数据集中NSUN2与耐药标志物或抑癌基因的相关性基因表达分析。
数据为三次生物学重复实验的平均值±SD。Ns(不显著),Ctrl(对照),Gef(吉非替尼),Osi(奥希替尼),*p < 0.05, **p < 0.01。
(2)NSUN2过表达促进吉非替尼体内和体外耐药

图2:NSUN2过表达导致吉非替尼耐药和肿瘤复发
a. 对PC-9细胞稳定转染野生型NSUN2 (NSUN2-WT)、双催化突变型NSUN2 (NSUN2-DM)和空载体质粒(Mock)的 NSUN2表达进行western blot分析。
b. 以梯度浓度吉非替尼处理PC-9-Mock、PC-9-NSUN2-WT、PC-9-NSUN2-DM细胞72 h,采用CCK-8法检测细胞活力及吉非替尼IC50。
c. 吉非替尼(1µM)处理PC-9-Mock、PC-9-NSUN2-WT、PC-9-NSUN2-DM细胞24 h后,western blot分析NSUN2蛋白水平。
d-f. BALB/c裸鼠皮下植入PC-9-Mock、PC-9-NSUN2-WT、PC-9-NSUN2-DM细胞(每组n≥6个)的肿瘤体积(d)、肿瘤重量(e)和小鼠生存期(f)。注射后约2周,分别给予吉非替尼25 mg/kg或0.5% CMC-Na灌胃,1次/ d,连续10 d(第15~24天)。
g. 从肿瘤异种移植获得的肿瘤ki67 IHC染色和定量H-scores评分代表性图像。
(3)NSUN2敲除可克服吉非替尼固有耐药

图3:NSUN2敲除在体外和体内克服了吉非替尼的固有耐药性。
a. 将靶向NSUN2 siRNA(siNSUN2)转染或非靶向对照siRNA(siCtrl)转染的H1650和H1975细胞用吉非替尼(1µM)处理72 h,并通过CCK-8法检测细胞活力,NSUN2敲除效果使用western blot进行评估分析(上图)。
b. 用吉非替尼(1µM)处理转染siNSUN2或siCtrl的H1650和H1975细胞72 h, 通过Annexin V-FITC/PI染色检测细胞凋亡;
c. H1650细胞转染siNSUN2或shNSUN2后,western blot分析检测EGFR蛋白表达。
d-e. 经shNSUN2预处理的H1650和H1975细胞用NSUN2-WT或NSUN2-DM稳定转染,通过CCK-8 (d)或克隆形成实验(e)检测细胞增殖,通过western blot (右图)分析NSUN2的拯救效果。
f-g. 皮下植入H1650-shCtrl和H1650-shNSUN2细胞的BALB/c裸鼠获得的肿瘤异种移植物的平均体积(f)和肿瘤重量(g)(每组n=7)。
h-i. 皮下植入小鼠模型中H1975-shCtrl和h1975 - shnsun2来源的肿瘤异种移植物的生长曲线(h)和平均肿瘤重量(i)(每组n =6)。
(4)YBX1可以作为m5C reader提高吉非替尼耐药性
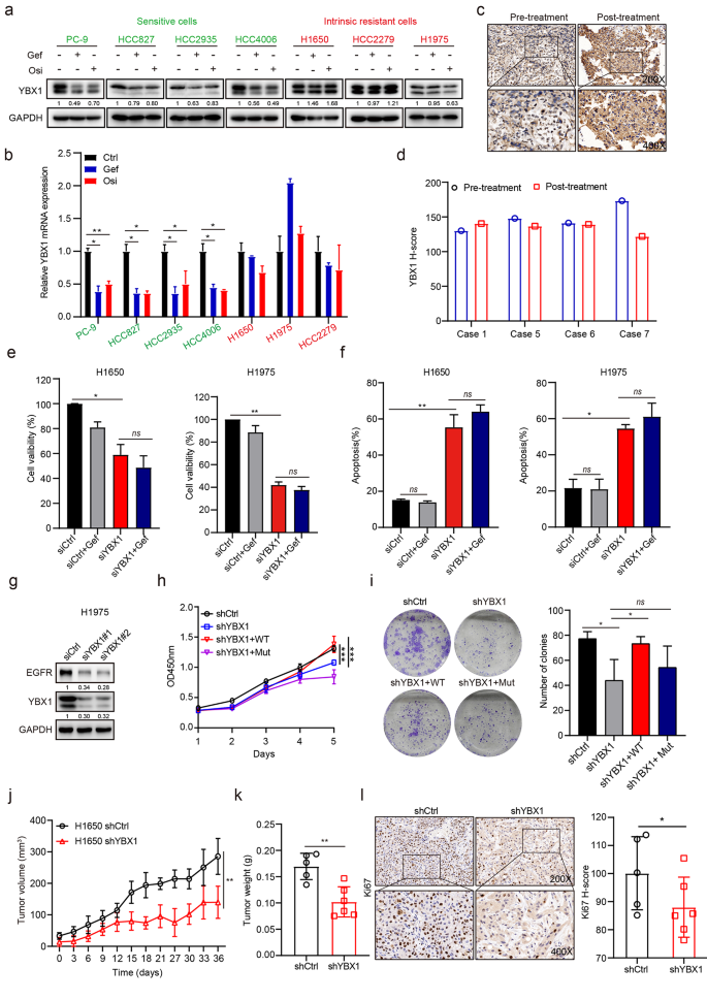
图4:m5C reader YBX1表达是吉非替尼固有耐药所必需的
a. 用吉非替尼(1µM)或奥希替尼(1µM)处理敏感性和耐药性细胞24 h, western blot检测YBX1蛋白表达水平。
b. 用吉非替尼(1µM)或奥希替尼(1µM)处理敏感性和耐药性细胞24 h后,qRT-PCR检测YBX1 mRNA表达。c-d. 吉非替尼固有耐药的NSCLC患者治疗前后活检YBX1 的IHC染色(c)和定量H-scores评分(d)。
e-f. 以吉非替尼(1µM)处理转染YBX1 siRNA的H1650和H1975细胞72 h,采用CCK-8法检测细胞活力(e), Annexin V-FITC/PI染色法检测细胞凋亡(f)。
g. western blot检测siYBX1转染H1975细胞EGFR蛋白表达。
h-i. 将shYBX1预处理的H1650细胞用野生型YBX1(YBX1-WT)或结合缺陷突变型YBX1 (YBX1- Mut, W65A) 稳定转染,并通过CCK-8 (h)或集落形成实验(i)检测细胞增殖。
j-k. 皮下植入BALB/c裸鼠从H1650-shCtrl和H1650-shYBX1异种移植物的肿瘤生长(j)和肿瘤重量(k)(n ≥ 5)。
l. 从H1650-shCtrl和H1650-shYBX1异种移植物获得的肿瘤ki67 IHC染色和定量H-scores评分代表性图像。
(5)QSOX1被鉴定为NSUN2介导的m5C高甲基化的潜在靶点

图5:表观转录组分析鉴定QSOX1是耐药NSCLC细胞中m5C修饰的靶标。
a-b. H1650细胞(a)和PC-9细胞(b)siNSUN2转染72h或吉非替尼(1µM)处理24h后,通过RNA-BS分析m5C平均水平。
c. m5C在对照组、NSUN2敲低组和吉非替尼处理组的H1650细胞不同区域分布。
d. H1650 siNSUN2#1细胞中m5C甲基化水平和mRNA表达水平发生显著变化。
e. 维恩图显示了直接靶向NSUN2的潜在m5C修饰候选基因。
f-g. IGV分析显示,NSUN2敲低或吉非替尼处理后,H1650 细胞(f)和PC-9细胞 (g)中QSOX1的mRNA表达和m5C水平发生变化。
h-j. 用抗m5C抗体免疫共沉淀纯化mRNA, qRT-PCR分析H1650 (h)、H1975 (i)和HCC2279 (j)中QSOX1的m5C水平。
(6)NSUN2以m5C-YBX1依赖的方式调控QSOX1 mRNA翻译

图6:NSUN2和YBX1通过调控mRNA翻译来调节QSOX1表达
a. 用siNSUN2或siCtrl转染H1650和H1975细胞72 h后,用相应抗体western blot分析全细胞裂解物。
b. 从H1650-shCtrl和H1650-shNSUN2异种移植物获得的肿瘤QSOX1 IHC染色和定量H-scores评分代表性图像。
c. 用siNSUN2预处理的H1650细胞用pcDNA-NSUN2-WT或pcDNA-NSUN2-Mut (C271A&C321A)质粒转染,western blot分析QSOX1表达。
d. 用200 nM嘌呤霉素处理siCtrl或siNSUN2转染的H1650或H1975细胞,用相应抗体western blot分析分析全细胞裂解物。
e. 将含有野生型或突变型(C-to-T/A突变) m5C位点的QSOX1 CDS克隆到荧光素酶报告载体中。
f. 分别转染shCtrl和shNSUN2的H1650细胞中,野生型和突变型QSOX1 CDS报告载体的相对荧光素酶活性。
g. western blot分析siCtrl和siYBX1转染的H1650和H1975细胞中QSOX1表达。
h. 以IgG为对照,用抗YBX1抗体在siCtrl或siNSUN2转染的H1650细胞中进行YBX1和QSOX1 mRNA免疫共沉淀。
i. 经shYBX1预处理的H1650细胞用3FLAG-YBX1-WT或3FLAG-YBX1-Mut (W65A)质粒转染,western blot分析QSOX1表达。
j. 用200 nM嘌呤霉素处理siCtrl或siYBX1转染的H1650或H1975细胞,用相应抗体进行western blot分析全细胞裂解物。
k. H1650细胞分别转染shCtrl和shYBX1后,野生型和突变型QSOX1 CDS报告载体的相对荧光素酶活性。l. 用siNSUN2或siYBX1单独或联合转染H1650细胞72 h后,用相应抗体western blot分析全细胞裂解物。
(7)QSOX1与吉非替尼固有耐药性相关
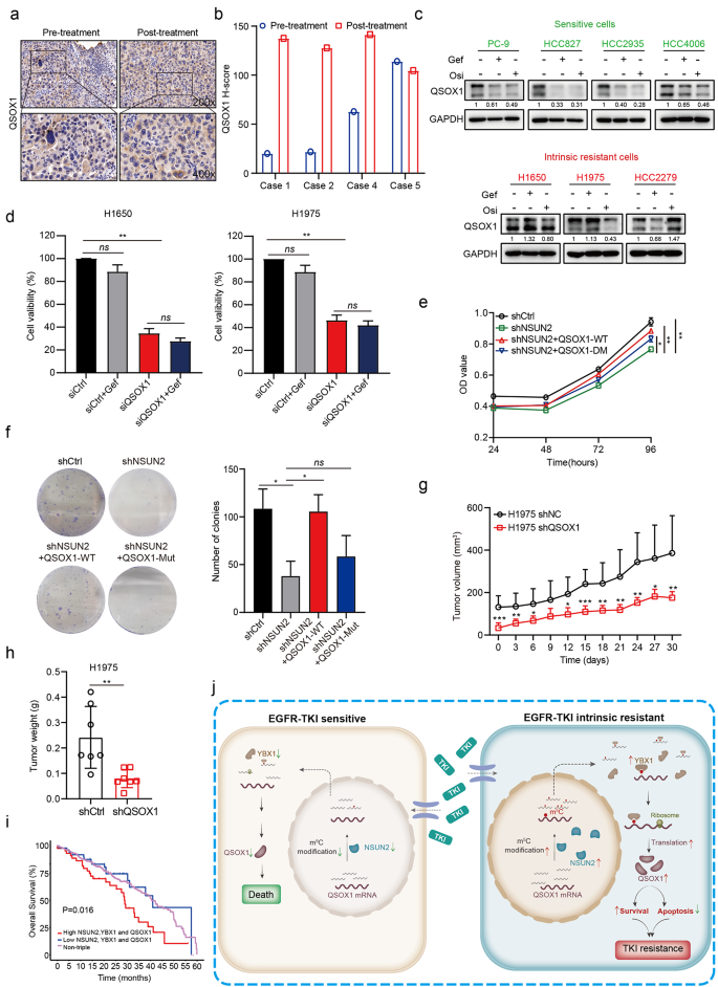
图7:QSOX1丰度调控NSCLC对吉非替尼的敏感性
a-b. 吉非替尼固有耐药的NSCLC患者治疗前后活检QSOX1 IHC染色(a)和定量H-scores评分(b)代表性图像。
c. 用吉非替尼(1µM)或奥希替尼(1µM)处理敏感性和耐药性细胞24 h, western blot分析QSOX1蛋白表达水平。
d. 用吉非替尼(1µM)处理经靶向QSOX1(siQSOX1)或非靶向对照(siCtrl)siRNA转染的H1650和H1975细胞72 h,采用CCK-8法检测细胞活力。
e-f. 经shNSUN2预处理的H1650细胞m5C位点用野生型QSOX1 (QSOX1-WT)或突变型QSOX1 (QSOX1-Mut)稳定转染,采用CCK-8 (e)或集落形成实验(f)检测细胞增殖。
g-h. BALB/c裸鼠皮下移植H1975-shCtrl和H1975-shQSOX1细胞异种移植物的的肿瘤生长曲线(g)和肿瘤重量(h) (每组n=7)。
i. TCGA-LUAD数据集的Kaplan-Meier分析显示NSUN2、YBX1和QSOX1联合高表达预测较差的总生存率。采用对数秩检验确定P值(P=0.016)。
j. 非小细胞肺癌中异常m5C高甲基化通过NSUN2/YBX1/QSOX1轴导致吉非替尼固有耐药性的工作模型。
结论
本研究表明,NSUN2-YBX1-QSOX1轴是调控NSCLC对EGFR-TKI固有耐药性的重要机制。抑制NSUN2-YBX1-QSOX1轴可以通过m5C依赖性调节机制克服吉非替尼的固有耐药性。研究结果强调了NSUN2-YBX1-QSOX1轴可以作为EGFR-TKI固有耐药的NSCLC患者预后和治疗的候选生物标志物。
关于易基因RNA m5C甲基化测序(RNA-BS)技术
m5C是RNA百余种修饰中研究较多的一种。m5C存在于tRNA上时,可以对翻译进行调节;存在于rRNA上时,可以对核糖体的生物合成进行质控;存在于mRNA上时,则可以影响mRNA的结构、稳定性及翻译过程。
易基因提供适用于不同科研需求的m5C甲基化测序技术:
◇ 常规mRNA m5C甲基化测序(RNA-BS):
mRNA分离后首先通过亚硫酸盐处理,非甲基化的C转变为U,m5C修饰的碱基保持不变,结合高通量测序,可以对RNA上的每一个C碱基修饰进行定位与定量。
◇ 常规mRNA +lncRNA m5C甲基化测序(全转录组RNA-BS):
易基因科技建立的升级版m5C RNA甲基化测序服务,去除人rRNA后,剩余RNA经重亚硫酸盐处理后,结合高通量NGS策略,可在全转录组范围内单碱基分辨率地检测基因m5C甲基化修饰分布。
技术优势:
l 高深度:超高深度重亚硫酸盐处理,检测准确性极高;
l 高通量:结合高通量NGS,全转录组范围内检测;
l 单碱基:单碱基分辨率,快速检测和分析RNA中的m5C。
l 高准确:精确的检测mRNA等每一个C碱基的的修饰水平。
研究方向:
Ø 与m6A甲基化类似,m5C甲基化已被证明与肿瘤、神经系统紊乱、代谢性疾病、病毒感染以及个体发育等密切相关。
Ø 此外,RNA甲基化(m5C)与人类疾病密切相关,其功能涉及调控干细胞应激、细胞毒性应激、mRNA出核和植物细胞发育及基因表达等方面。
实验策略:
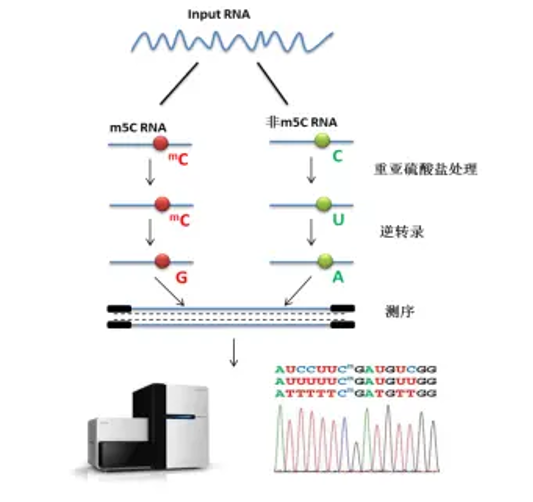
易基因RNA m5C甲基化建库测序示意图
易基因科技提供全面的RNA甲基化研究整体解决方案,技术详情了解请致电易基因0755-28317900。

参考文献:
Wang Y, Wei J, Feng L, Li O, Huang L, Zhou S, Xu Y, An K, Zhang Y, Chen R, He L, Wang Q, Wang H, Du Y, Liu R, Huang C, Zhang X, Yang YG, Kan Q, Tian X. Aberrant m5C hypermethylation mediates intrinsic resistance to gefitinib through NSUN2/YBX1/QSOX1 axis in EGFR-mutant non-small-cell lung cancer. Mol Cancer. 2023 May 9;22(1):81.
相关阅读:
干货:手把手教你做RNA m5C甲基化测序分析(RNA-BS)