
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
精原干细胞移植(Spermatogonial stem cell transplantation,SSCT)被提议作为儿童癌症幸存者的生育疗法。SSCT首先冷冻保存睾丸活检,然后再进行性腺毒性治疗(如癌症治疗)。当儿童癌症幸存者成年并想要亲生孩子时,可以将活检组织解冻并在体外增殖精原干细胞(SSC),随后将其自动移植回睾丸。然而,长期增殖过程中的培养应激可能会导致SSC的表观遗传学变化,如DNA甲基化变化,并可能遗传给SSCT后出生的子代。因此,在临床实施这种新型细胞疗法之前,SSCT需要对衍生子代进行详细的临床前表观遗传学评估。
2023年04月07日,荷兰阿姆斯特丹大学UMC生殖医学中心生殖生物学实验室Callista L Mulder团队在《Clin Epigenetics》杂志发表了题为“Sperm DNA methylation is predominantly stable in mice offspring born after transplantation of long-term cultured spermatogonial stem cells”的研究论文,该研究通过使用简化甲基化测序(RRBS)在多代小鼠模型中研究了SSCT衍生子代具有体外增殖SSC精子的DNA甲基化状态。

标题:Sperm DNA methylation is predominantly stable in mice offspring born after transplantation of long-term cultured spermatogonial stem cells在长期培养的精原干细胞移植后出生的小鼠后代中,精子DNA甲基化水平稳定
时间:2023.04.07
期刊:Clinical Epigenetics
影响因子:IF 7.259
技术平台:RRBS、BSP、RT-qPCR等
样本实验:

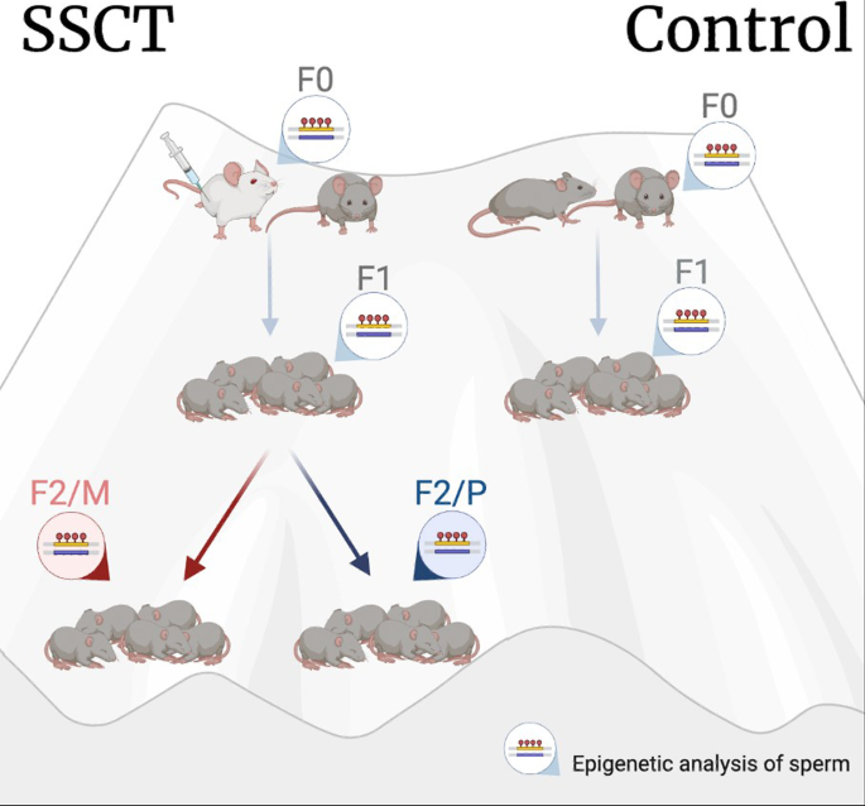
研究设计:SSCT子代的多代小鼠模型
F0:移植小鼠,F1:SSCT后出生的第一代,F2:SSCT后亲本出生的第二代,F2/M:F2由母系产生,F2/P:F2由父系产生。从代际子代的5只雄性小鼠采集附睾精子,比较DNA甲基化状态(F0的n=3,F1和F2的每个子代亚组n=5)
研究结果:
通过对第一代和第二代SSCT出生小鼠子代的精子进行RRBS DNA甲基化测序分析,以此来评估SSCT衍生子代的分子表观遗传稳定性,并将其与对照组精子进行比较分析。研究结果表明,在所有子代中,DNA甲基化差异比例占总CpG和甲基化区域不到0.5%。所有样品的无监督聚类分析没有显示出基于甲基化差异模式的明显分组。对与对照组相比在多代SSCT子代中显著变化的少数单个基因用定量亚硫酸盐Sanger测序(BSP)和RT-qPCR在不同器官中进行了验证。仅Tal2的差异甲基化得到证实,与对照F1相比,Tal2在SSCT子代的精子中低甲基化,且在SSCT F1子代的卵巢中表现出更高的基因表达。表明在F1代和F2代精子中,SSCT衍生的子代和对照组之间的DNA甲基化没有显著差异。
研究图表:
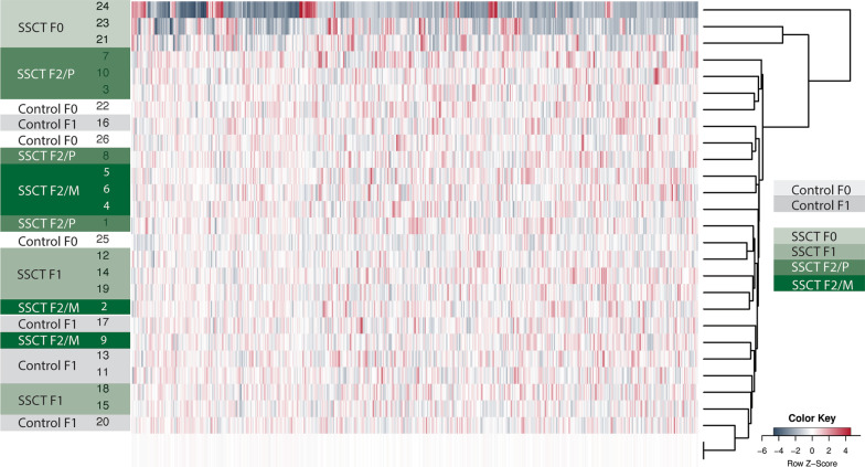
图1:所有样品平均甲基化的无监督聚类热图。
所有样本的热图聚类基于每个样本之间的显著差异甲基化(F0 n=3在,F1和F2 子代亚组n=5)和所有样品的平均甲基化(duplo),热图中包括前500个变化最大的DMR(高甲基化和低甲基化)的中浅灰色的最后2行
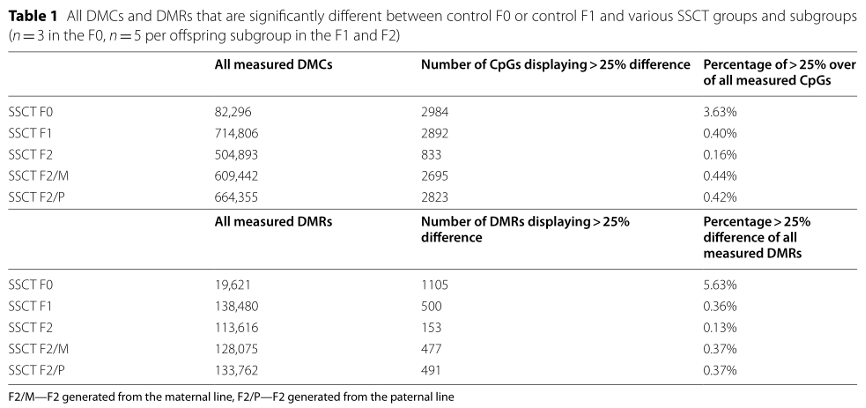
表1:对照组F0/对照组F1与SSCT组/SSCT亚组之间显著差异的所有DMC和DMR
图2:与对照组F1相比,SSCT F1和SSCT F2的CpG位点的差异分析(DMC)。
A. 火山图显示了SSCT样品和对照样品之间CpG甲基化模式变化的CpG数量,显著高于或低于25%差异截止值并考虑了q值阈值为0.01。x轴和y轴上的值分别是校正后p值的甲基化差异百分比和-log10。
B. 代际间的差异甲基化CpG(DMC)在DNA区域外显子、内含子、启动子和基因间区域的分布。
图3:与对照F1相比,SSCT F1和SSCT F2子代的DMR差异分析。
A. 火山图显示了SSCT样品和对照样品之间甲基化模式改变的DMR数量。
B. DNA区域外显子、内含子、启动子和基因间区域的差异甲基化区域(DMR)分布。
表2:在SSCT F0、SSCT F1和SSCT F2代际之间的外显子和启动子区域中共有的DMR变化基因(粗体字体),这些基因将进一步验证
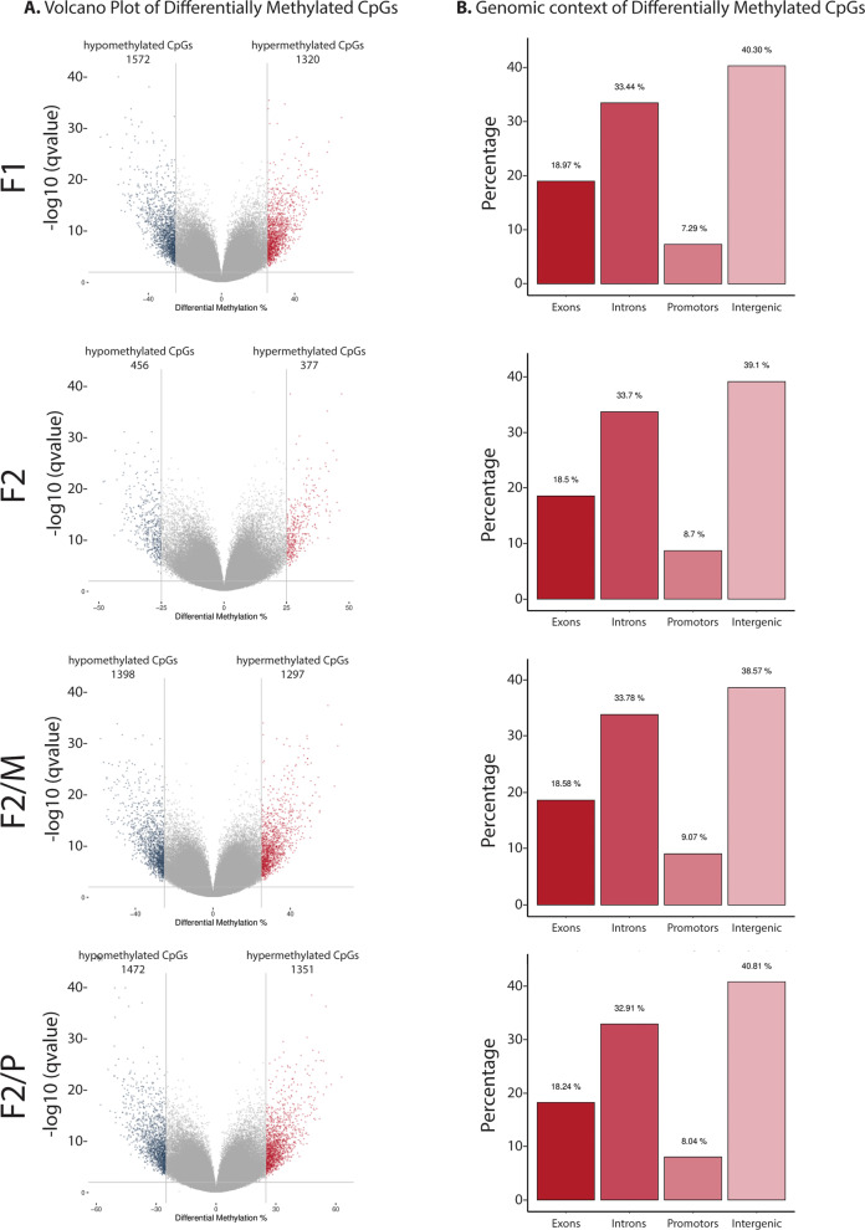
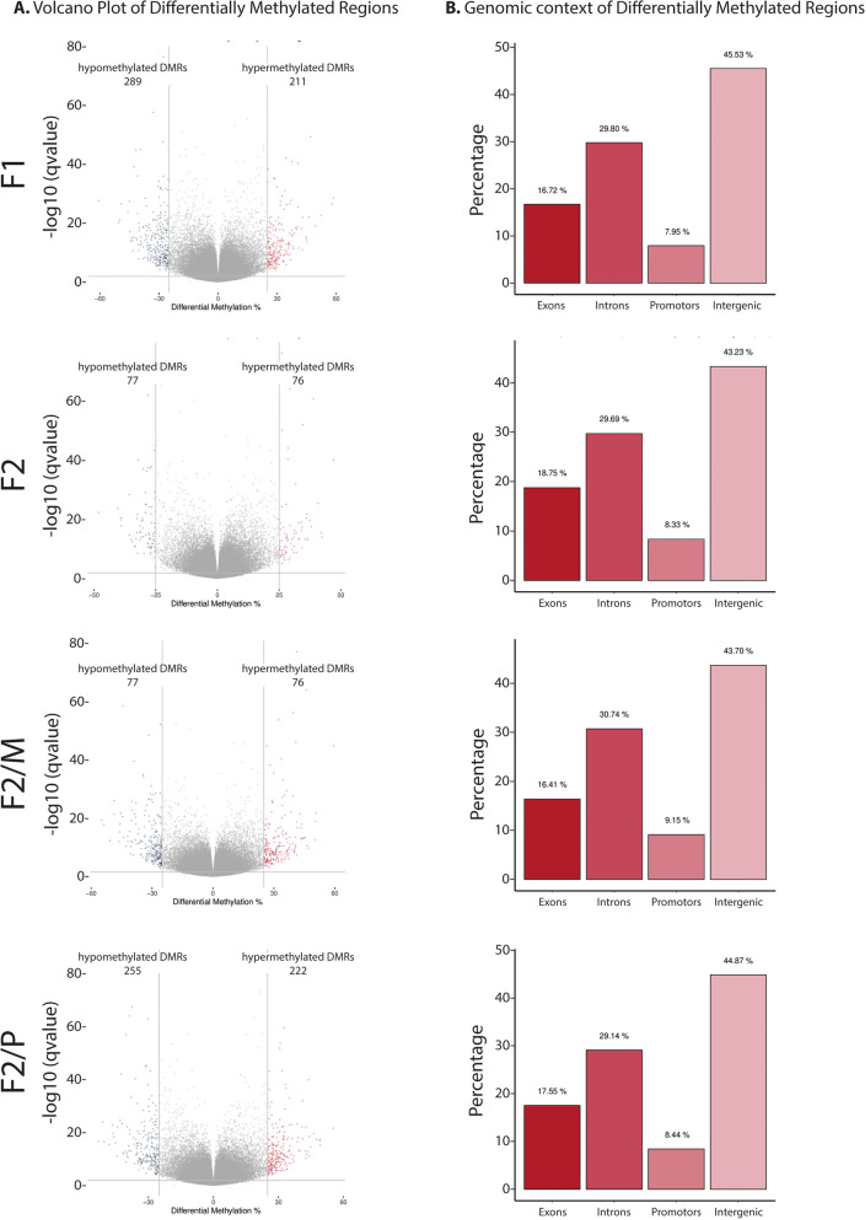
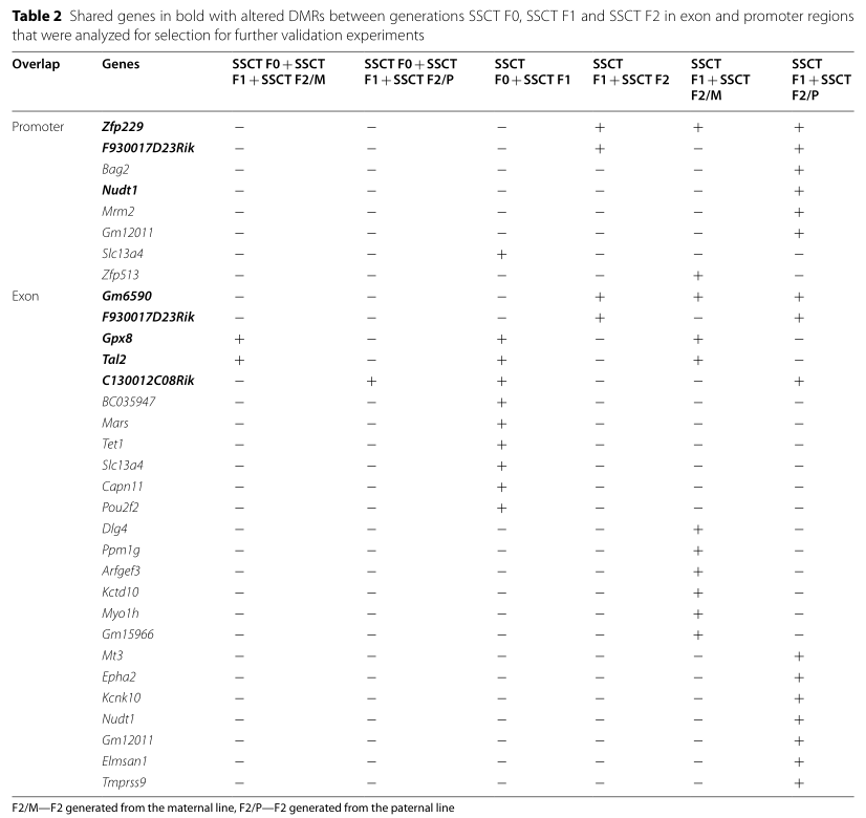
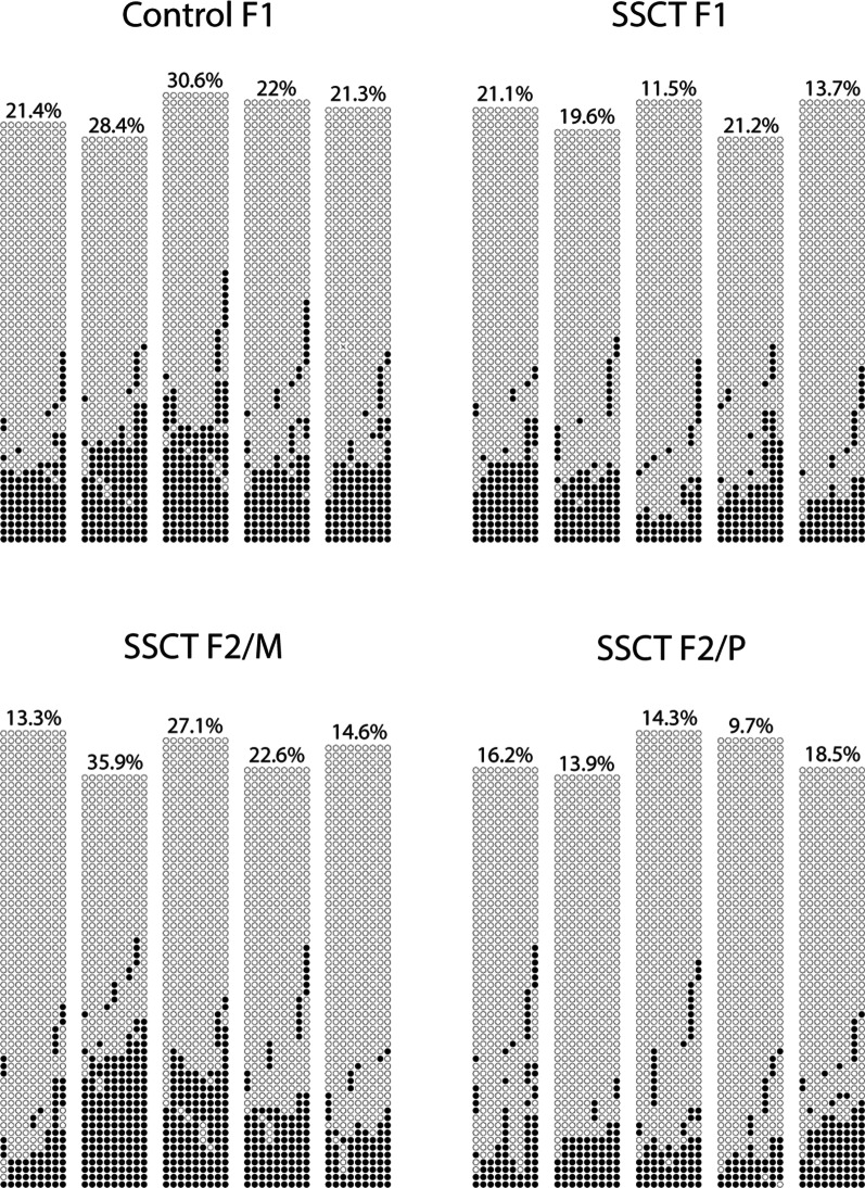
图4:对单个精子样本的Tal2基因的RRBS结果进行BSP验证。整体CpG平均值如下:对照F1 24.7%±4.4%、SSCT F1 17.4%±4.5%、SSCT F2/M 22.7%±9.3%、SSCT F2/P 14.5%±3.2%表现出SSCT和对照之间甲基化差异最大(10%)。
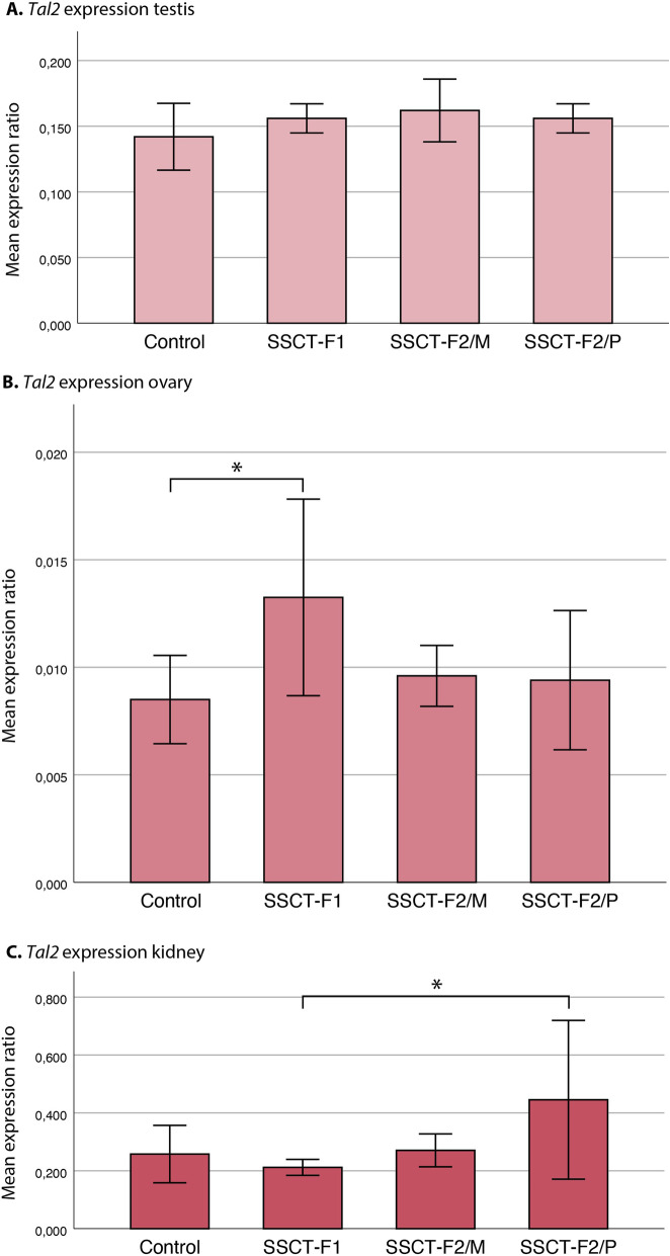
图5:RT-qPCR比较Tal2基因表达分析
F1、F2/M和F2/P中对照组F1和SSCT子代之间的睾丸(A)、卵巢(B)和肾(C)的平均表达率。条形图和ANOVA的统计分析以及Tukey事后检验代表了代际组之间的RNA表达,(每个器官n=5,F1和F2中的每个子代亚组,在技术三倍体中进行RT-PCR)*两组间观察到统计学显著差异(p < 0.05)。
易基因小结:
本研究可以得出结论,SSCT衍生子代的精子中存在一些表观“突变”(epimutations),但可以放心的是,这些“突变”没有重大的病理影响。一旦人类SSC培养得到优化并证实表观遗传学安全,这项关于表观遗传稳定性的研究以及之前关于多代SSCT子代一般健康状况的研究可用于申请在Ⅰ期临床试验中引入SSCT的伦理批准以及对儿童的随访。
关于易基因简化基因组甲基化测序(RRBS)研究解决方案
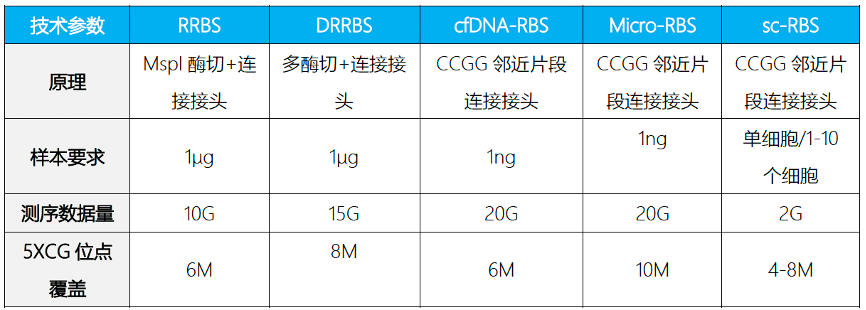
简化甲基化测序(Reduced Representation Bisulfite Sequencing,RRBS)是利用限制性内切酶对基因组进行酶切,富集启动子及CpG岛等重要的表观调控区域并进行重亚硫酸盐测序。该技术显著提高了高CpG区域的测序深度,在CpG岛、启动子区域和增强子元件区域可以获得高精度的分辨率,是一种准确、高效、经济的DNA甲基化研究方法,在大规模临床样本的研究中具有广泛的应用前景。
为适应科研技术的需要,易基因进一步开发了可在更大区域内捕获CpG位点的双酶切RRBS(dRRBS),可研究更广泛区域的甲基化,包括CGI shore等区域。
为助力适用低起始量DNA样本(5ng)量多维度甲基化分析,易基因开发了富集覆盖CpG岛、启动子、增强子、CTCF结合位点的甲基化靶向基因组测序方法:extended-representation bisulfite sequencing(XRBS),实现了高灵敏度和微量样本复用检测,使其具有高度可扩展性,并适用于有限的样本和单个细胞基因组CG位点覆盖高达15M以上。
技术优势:
Ø 起始量:100ng gDNA;
Ø 单碱基分辨率;
Ø 多样本的覆盖区域重复性可达到85%-95%、测序区域针对高CpG调控区域,数据利用率更高;
Ø 针对性强,成本较低;
Ø 基因组CG位点覆盖高达10-15M,显著优于850K芯片。
应用方向:
RRBS/dRRBS/XRBS广泛应用于动物,要求全基因组扫描(覆盖关键调控位点)的:
Ø 队列研究、疾病分子分型、临床样本的甲基化 Biomarker 筛选
Ø 复杂疾病及肿瘤发病机制等甲基化研究
Ø 模式动物发育和疾病甲基化研究
易基因科技提供全面的DNA甲基化研究整体解决方案,详询易基因0755-28317900。
参考文献:
Serrano JB, Tabeling NC, de Winter-Korver CM, van Daalen SKM, van Pelt AMM, Mulder CL. Sperm DNA methylation is predominantly stable in mice offspring born after transplantation of long-term cultured spermatogonial stem cells. Clin Epigenetics. 2023 Apr 7;15(1):58.
相关阅读: