
喜报!易基因单细胞转录组Smart-seq2技术服务见刊《nature communications》(IF 16.6 / 1区)
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
2024年2月16日,海南大学周非凡教授和骆清铭院士为共同通讯在《nature communications》(自然通讯)杂志发表题为“Non-invasive modulation of meningeal lymphatics ameliorates ageing and Alzheimer’s disease-associated pathology and cognition in mice”的研究论文,研究利用近红外激光(808 nm)对衰老及阿尔茨海默病(Alzheimer's disease, AD)小鼠进行无接触经颅光疗,利用单细胞及微量转录组测序(Smart-seq2)等分析揭示光疗可以显著提升脑膜淋巴系统的引流功能,从而实现小鼠的病理缓解及认知提升。深圳易基因科技为本研究提供单细胞及微量转录组测序技术服务。

标题:Non-invasive modulation of meningeal lymphatics ameliorates ageing and Alzheimer’s disease-associated pathology and cognition in mice(脑膜淋巴管的非侵入性调控可改善小鼠的衰老和阿尔茨海默氏病相关的病理和认知提升)
时间:2024年2月16日
发表期刊:nature communications
影响因子:IF 16.6 / 1区
技术平台:单细胞及微量转录组测序(Smart-seq2)等

研究背景:
2015年,位于硬脑膜的脑膜淋巴管(meningeal lymphatic vessels,mLVs)被发现,构成了广泛的淋巴引流网络,以清除大分子废物和炎症介质,直接免疫细胞转运,并协调中枢神经系统(CNS)的免疫反应。
阿尔茨海默病(AD)是一种与年龄相关的神经退行性疾病,死亡率很高。AD的主要病理特征是β-淀粉样蛋白(β-amyloid,Aβ)异常聚集和大脑中的神经元缠结,导致神经元功能障碍和认知能力下降。MLV 随着年龄增长或 AD 进展而功能退化,这可能是认知功能障碍和神经损伤加剧的潜在因素。通过枕大池(intracisterna magna)内注射病毒介导的血管内皮生长因子C(VEGF-C)治疗可以有效增强mLVs功能,进而增强淋巴引流以清除中枢神经系统中的有毒分子,并提高学习和记忆能力。因此,mLV可能是与年龄相关认知缺陷的治疗靶点。然而,对于如AD等慢性和进行性神经退行性疾病,侵入性治疗模式并不可行。因此,开发非侵入性治疗方式对于AD治疗非常必要。
mLVs 网络浅表分布在硬脑膜中,这为经颅神经调控治疗提供了一种很有前途的策略,通过 mLVs 引流调控来缓解 CNS 疾病。本研究基于组织穿透的光学窗口,证明了近红外光可以调控脑膜淋巴内皮细胞(meningeal lymphatic endothelial cells,mLEC)功能,同时又促进mLVs引流,以缓解病理学并增强老年和AD小鼠的认知功能。本研究结果表明,光对mLECs线粒体代谢稳态的增强可以促进细胞粘附和生长,这可能增强细胞功能和mLECs连接,以进一步促进中枢神经系统中的脑膜淋巴转运以改善病理。
研究摘要:
脑膜淋巴管(MLV)参与淀粉样蛋白β(Aβ)的清除,被认为是阿尔茨海默病(AD)的潜在治疗靶点。本研究基于MLV的表层空间分布,采用近红外光调节淋巴引流,显著改善老年小鼠和AD(5xFAD和APP/PS1)小鼠的认知,并通过减少aβ沉积、神经炎症和神经元损伤等来改善AD相关病理。此外透射电子显微镜成像和RNA测序(Smart-seq2)数据表明,通过光调节改善了脑膜淋巴管内皮细胞(MLEC)的线粒体代谢和细胞连接。这些研究共同表明,近红外光治疗可以通过恢复mLEC功能来增强MLV清除能力,从而改善认知功能。总之,光的淋巴引流增强促进了衰老和AD小鼠模型的病理缓解和认知增强,为神经退行性疾病提供了潜在的改善策略。
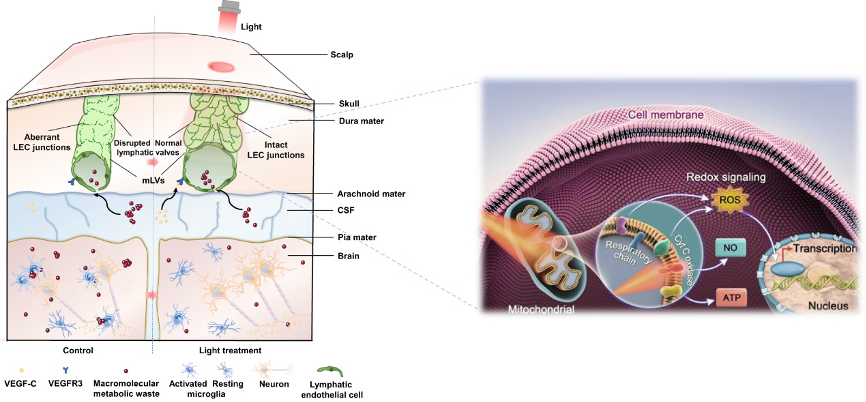
mLVs靶向光疗改善AD病理的机制示意图
近红外光通过光感受器CcO增强MLEC中的线粒体代谢,CcO修复淋巴细胞连接并安排恢复MLV引流,促进废物大分子(Aβ)清除,最终缓解小鼠神经退行性过程。
研究结果:
(1)光调节 mLVs 引流并改善老年小鼠的认知能力下降:15-17个月的老年C57BL/6J小鼠实验确定近红外光疗最佳剂量和改善认知疗效
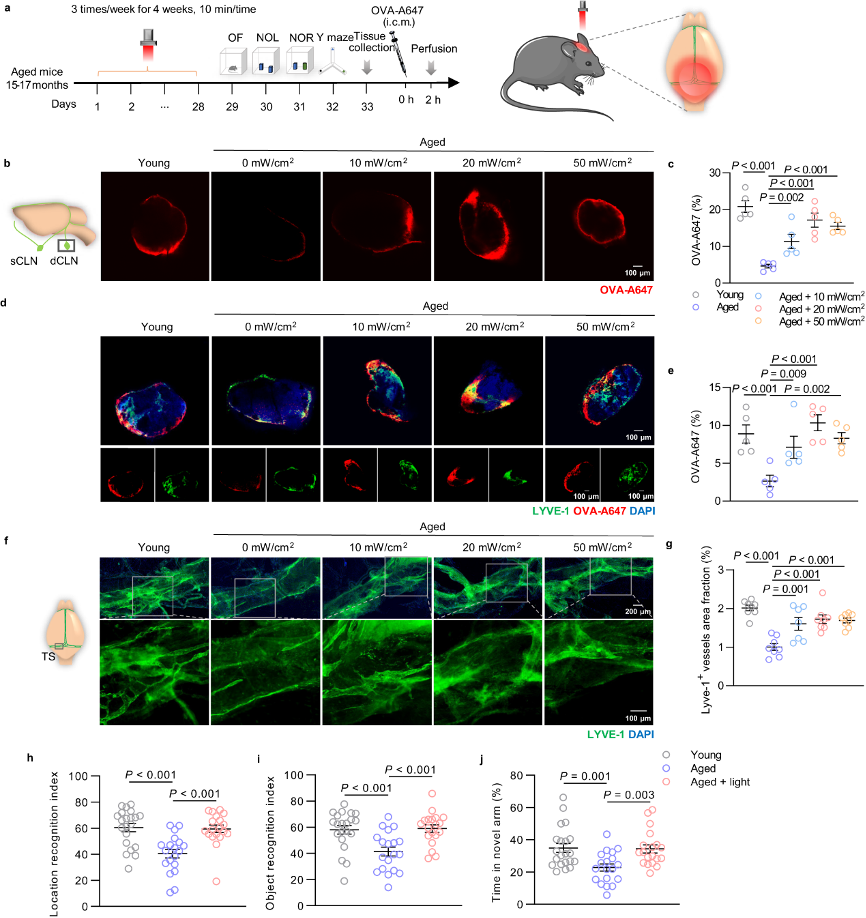
图1:光对老年小鼠认知和mLVs引流的影响
(2)光调节减轻AD小鼠的认知能力下降和病理损伤:6个月的5xFAD小鼠和11个月的APPswe/PS1ΔE9小鼠实验证实近红外光疗可减轻AD小鼠的认知能力下降和病理损伤。
从海马体(hippocampus,HPC)组织中提取总RNA并测序(图2r、s,补充图6):
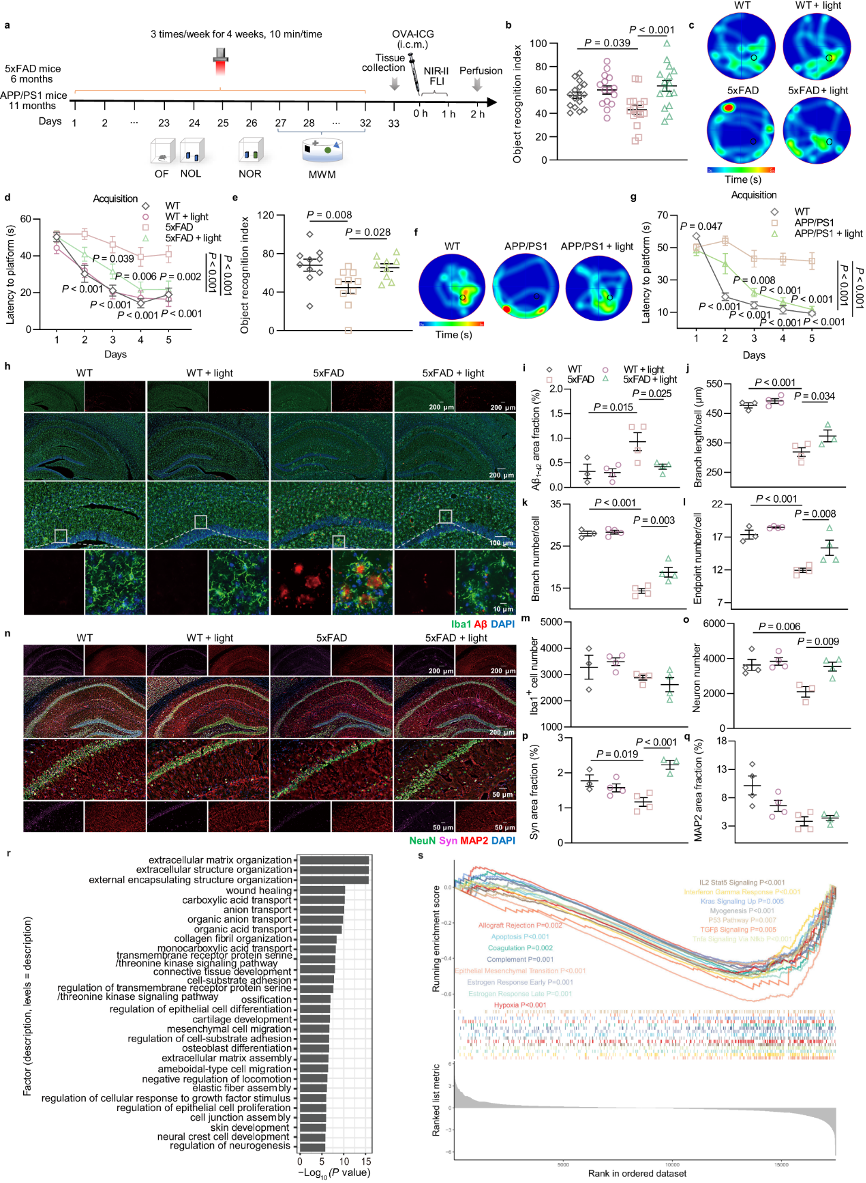
图2:光对AD小鼠认知和病理学的改善作用。
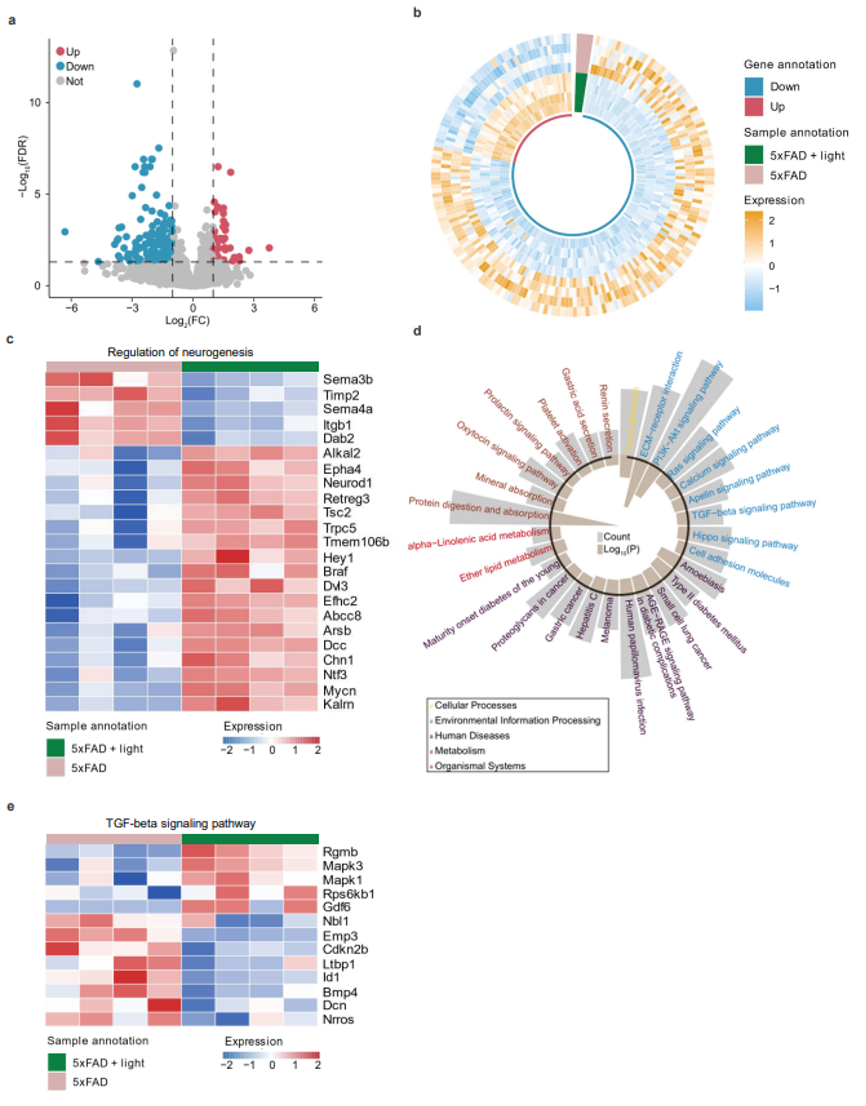
补充图6:光对5xFAD小鼠海马体相关基因表达的改善效果。
a-b. 火山图(a)和热图(b)显示了光处理组与5xFAD组之间海马体差异表达基因(DEGs)的上调和下调。
c. 热图显示参与神经发生调控的DEGs的相对表达水平。
d. 比较组间海马体组织DEGs 的KEGG富集分析。
e. 热图显示参与TGF-beta信号通路的DEGs的相对表达水平。a-e数据中每组有4只小鼠。
(3)光对mLV结构的调节增强了mLV引流
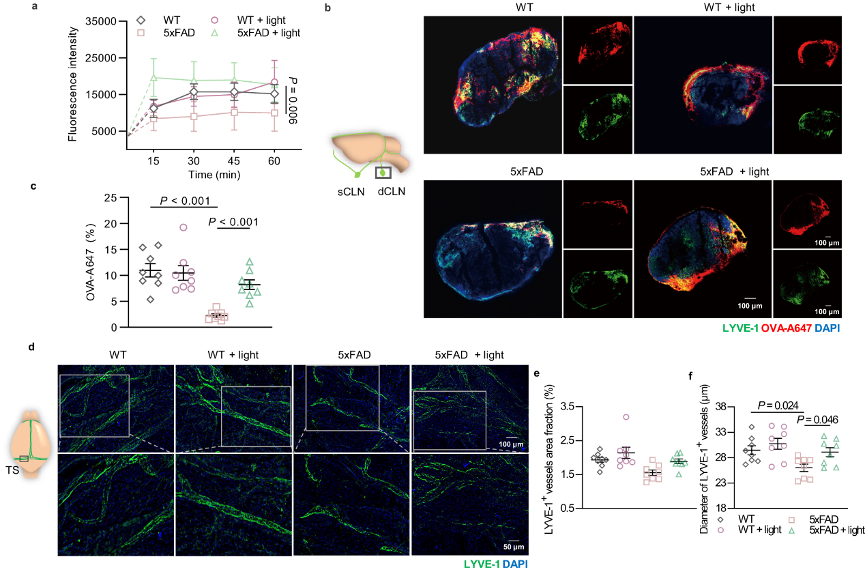
图3:光对5xFAD小鼠mLV引流功能和结构变化的改善作用。
(4)促进mLVs引流是光改善认知的必要条件

图4:光对mLVs消融小鼠认知和淋巴引流的影响
(5)脑膜淋巴内皮细胞(meningeal lymphatic endothelial cells,mLEC)的线粒体稳态和细胞功能受光调节
从脑膜组织中提取总RNA并测序(图5c-g,补充图11)
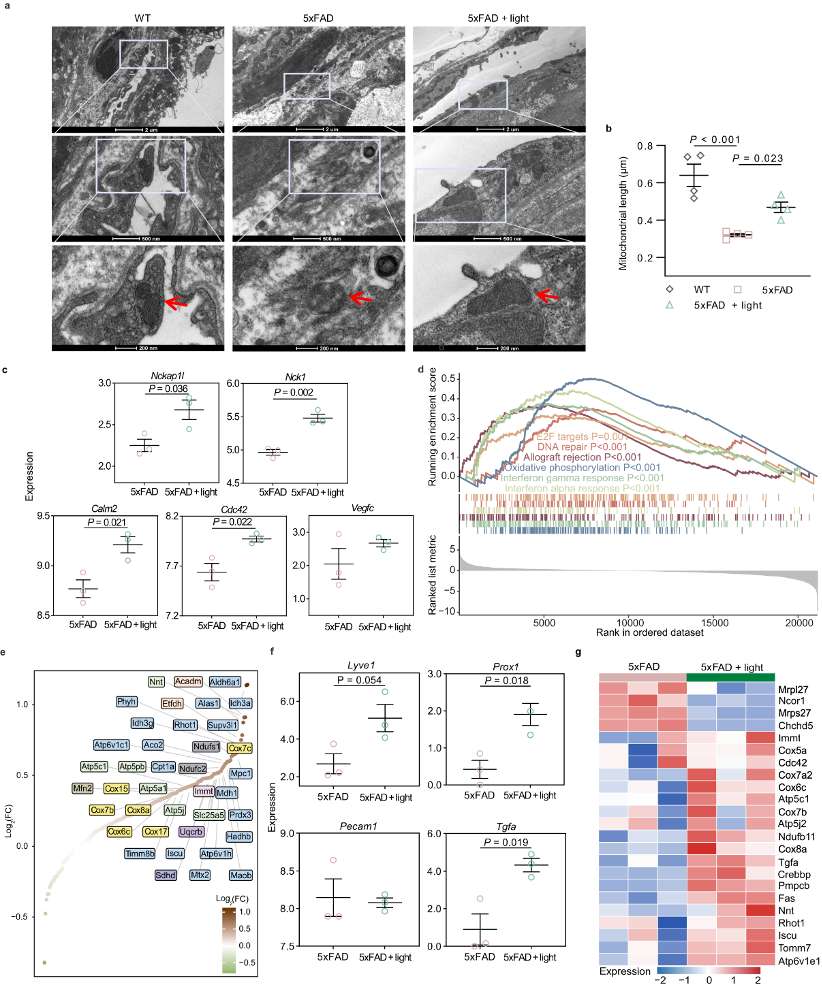
图5:光对5xFAD小鼠mLVs微观结构和基因表达的改善作用
a. mLEC排列和线粒体形态的代表性透射电子显微镜(TEM)图像(红色箭头:mLEC的线粒体)(2个重复)。比例尺= 2μm、500nm或200nm。
b. mLECs线粒体长度的定量分析。每组n = 4只小鼠。
c. 光处理AD组和AD组脑膜中Nckap1l、Nck1、Calm2、Cdc42和Vegfc的表达水平。
d. 通过基因集富集分析(GSEA)的Hallmark基因组富集图,显示运行富集评分的轮廓和基因集成员在排序表位置。
e. 散点图显示线粒体氧化磷酸化富集基因,并根据Log2(FC)(FC:倍数变化)排序。
f. 光处理AD组和AD组mLECs中Lyve1、Prox1、Pecam1和Tgfa的表达。
g. 热图显示参与线粒体代谢的mLECs中DEGs的相对表达水平。
每组数据n=3只小鼠(数据c-g)。b、c、f中的数据均值±SEM,并通过单因素方差分析(ANOVA)与Sidak多重比较测试进行多组比较(b),或双尾未配对Student's t-test进行两组比较(c, f)。

补充图11:光对5xFAD小鼠脑膜基因表达的改善效果。
a. 5xFAD小鼠用LYVE-1、线粒体超氧化物指示剂(MitoSOX)和四甲基罗丹明(TMRE)染色的mLVs代表性图像(2个生物学重复)。比例尺 = 10μm。
b. 通过MitoSOX荧光定量检测mLECs中线粒体超氧化物。
c. 通过TMRE荧光定量检测mLECs中线粒体膜电位。
d. 老年小鼠用LYVE-1、MitoSOX和TMRE染色的mLVs代表性图像(2个生物学重复)。比例尺= 10μm。
e. 通过MitoSOX荧光定量检测mLECs中线粒体超氧化物。
f. 通过TMRE荧光定量检测mLECs中线粒体膜电位。b、c、e、f数据中每组n=4只小鼠。
g-h. 火山图(g)和热图(h)显示了与假手术组相比,接受光治疗的5xFAD小鼠脑膜中上调和下调的差异表达基因(DEGs)。颜色比例尺值代表跨样本的标准化对数值。
i. 相似性矩阵展示了上调的GO生物过程聚类,右侧词云包含显著GO的过表达关键词。
j-l. 比较光处理5xFAD组与5xFAD组脑膜中所有DEGs(j)、上调DEGs(k)和下调DEGs(l)的KEGG功能富集分析,通过Log10(P值)衡量。g-l数据中每组n=3只小鼠。b、c、e、f中的数据均值±SEM,并通过单因素方差分析(ANOVA)与Sidak多重比较测试进行多组比较。
从脑膜中分离出mLEC进行RNA-seq分析(补充图12)
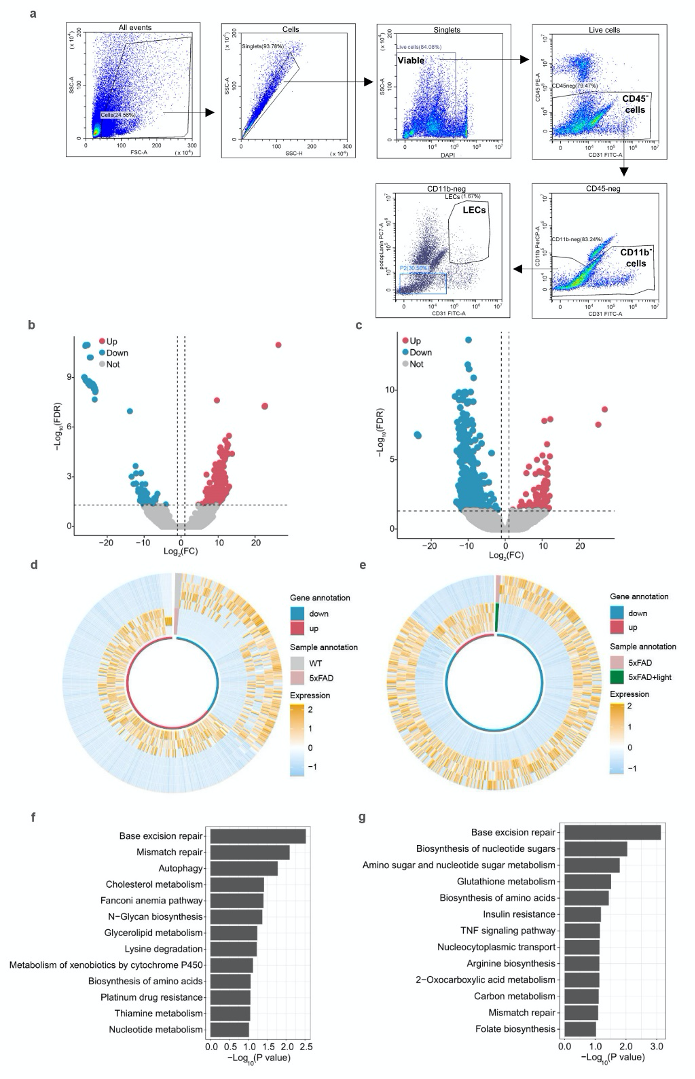
补充图12:光对5xFAD小鼠mLECs基因表达的改善效果。
a. 代表性图表显示通过荧光激活细胞分选(FACS)从不同组小鼠脑膜中分离mLECs的门控策略。
b-c. 5xFAD组与野生型(WT)组(b)、光处理5xFAD组与5xFAD组(c)之间mLECs的差异表达基因(DEGs)火山图。
d-e. 5xFAD组与WT组(d)、光处理5xFAD组与5xFAD组(e)mLECs的DEGs热图。
f-g. 5xFAD组与WT组之间下调基因(f)、光处理5xFAD组与5xFAD组上调基因(g)的KEGG功能富集分析。
数据a-g中,WT组n=4只小鼠,5xFAD组和光处理5xFAD组n = 3只小鼠。
参考文献:Wang M, Yan C, Li X, Yang T, Wu S, Liu Q, Luo Q, Zhou F. Non-invasive modulation of meningeal lymphatics ameliorates ageing and Alzheimer's disease-associated pathology and cognition in mice. Nat Commun. 2024 Feb 16;15(1):1453. pii: 10.1038/s41467-024-45656-7. doi: 10.1038/s41467-024-45656-7. PubMed PMID: 38365740.