
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
环境因素如饮食和生活方式,可以影响哺乳期母体及其子代的健康,但其跨代传递及潜在机制尚不清楚。研究表明,父母的饮食模式和生活方式可以影响子代的健康;同时大量研究表明孕产妇营养状况与子代健康之间存在相关性。母乳中的生物活性物质和营养物质支持婴儿的免疫发育和身体生长。而母体蛋白质营养不良、西方饮食、高纤维未加工饮食、高糖饮食和低纤维饮食等已被证明可以影响子代表型,这与健康和疾病发育起源(DOHaD)的假设一致。尽管亲本饮食对子代的影响已被广泛研究,但其潜在机制和跨代传递知之甚少。
DNA甲基化在生殖细胞特异性、成熟和早期发育中起着至关重要的作用。在雌性生殖细胞中,DNA甲基化发生在出生后,并持续到青春期,且DNA甲基化可以在哺乳动物中跨代传递。DNA甲基化易受环境因素影响,父体低蛋白饮食可以诱导精子DNA低甲基化,而子宫内营养不良则扰乱卵母细胞和精子甲基化。母体高脂饮食影响卵母细胞DNA甲基化,产前饥荒也会影响与生长和代谢疾病相关基因的DNA甲基化状态。但目前尚不清楚哺乳期母体饮食如何影响子代健康。
近日,中国科学院动物研究所顾林舰博士为第一作者、广东省第二人民医院孙青原教授为通讯作者在《Journal of Genetics and Genomics》(JGG)期刊发表题为“The transgenerational effects of maternal low-protein diet during lactation on offspring“的研究成果,该研究使用母体哺乳期低蛋白饮食(LPD)的小鼠模型,研究LPD饮食如何通过卵母细胞的DNA甲基化变化及其基因调控等表观遗传影响子代的生存、生长、繁殖能力以及代谢健康,并探讨其跨代传递的潜在机制。易基因为本研究提供scRRBS分析技术服务。

标题:The transgenerational effects of maternal low-protein diet during lactation on offspring(哺乳期母体低蛋白饮食对子代的影响)
期刊:《Journal of Genetics and Genomics》(JGG)
影响因子: IF 6.6
技术平台:scRRBS、scRNA-seq(Smart-Seq2)、16s等
本研究利用母体哺乳期低蛋白饮食(LPD)小鼠模型,展示了母体LPD在哺乳期会导致存活率下降和生长迟缓,显著减少排卵和窝仔大小,并改变雌性LPD子代的新陈代谢、肠道微生物组和卵母细胞转录组。LPD-F1中期II(MII)卵母细胞转录组测序分析结果表明,差异表达基因在女性妊娠和多个代谢过程中富集。母体LPD导致早期生长迟缓并损害代谢健康,这些影响可以传递超过两代。研究还利用采用单细胞简化基因组亚硫酸盐测序 (scRRBS)来分析LPD和LPD-F1卵母细胞甲基化模式变化部分可以传递给F2卵母细胞,阐明哺乳期间母体营养如何影响子代的生殖细胞 DNA 甲基化,从而探索跨代传递机制。总之,本研究结果揭示了LPD在哺乳期通过卵母细胞表观遗传变化跨代传递影响子代健康。
研究方法:
本研究使用母体哺乳期低蛋白饮食(LPD)小鼠模型,研究哺乳期母体LPD对子代发育和代谢的影响。研究中,LPD-F0雌鼠在哺乳期间体重低于对照饮食(CD)-F0。通过检测F1和F2代小鼠的体重变化、繁殖能力、葡萄糖耐量和胰岛素耐量,以及对F1代成年雌性卵母细胞进行单细胞RNA测序(scRNA-seq)和单细胞简化基因组重亚硫酸盐测序(scRRBS)分析,研究母体LPD对卵母细胞转录组和甲基化模式的影响。
研究结果
研究发现,母体LPD在哺乳期会导致F1代和F2代子代生长迟缓、存活率降低和繁殖能力下降。F1代雌性子代的窝仔数减少,自然排卵数量减少。F2代虽然出生体重正常,但在早期体重增长缓慢。此外,母体LPD还导致子代代谢健康受损,这种影响在两代中都有所体现。F1代卵母细胞的甲基化模式发生显著变化,这些变化部分可以传递给F2代卵母细胞。研究表明,哺乳期母体LPD通过卵母细胞的表观遗传变化,对子代健康产生跨代传递。这些发现揭示了母体饮食与子代健康之间的潜在分子联系,并为进一步研究提供了新的视角。
(1)哺乳期的母体低蛋白饮食影响子代健康。

图1:哺乳期母体低蛋白饮食(LPD)影响子代的发育和繁殖。
A:实验设计。
B:断奶时CD-F1或LPD-F1的存活率。
C:F1雌性子代的体重轨迹(n CD_F1=13, n LPD_F1=12)。
D:F1子代的窝仔大小。
E:F1子代的自然排卵。
F:F2子代的出生体重。
G:F2雌性子代的体重轨迹(n CD_F2=12, n LPD_F2=10)。
H:F2子代的窝仔大小。
I:F3子代的出生体重。
(2)哺乳期母体低蛋白饮食(LPD)导致子代葡萄糖代谢紊乱
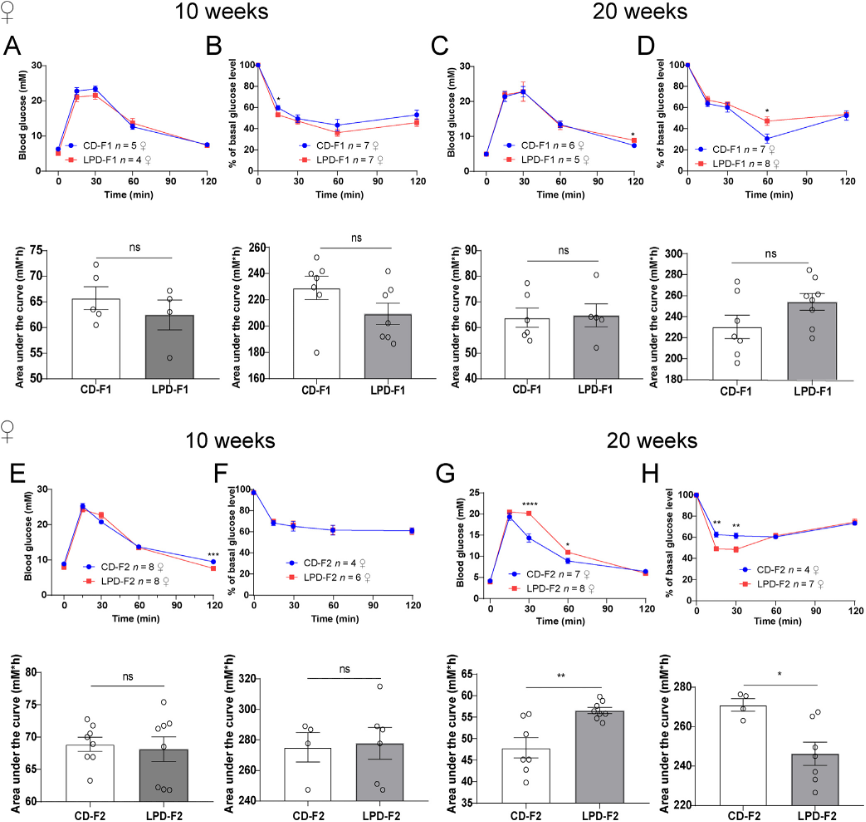
图2:10周和20周龄LPD-F1和LPD-F2雌性子代的葡萄糖耐量试验(GTT)和胰岛素耐量试验(ITT)。
(3)成年雌性F1子代的肠道微生物组变化。
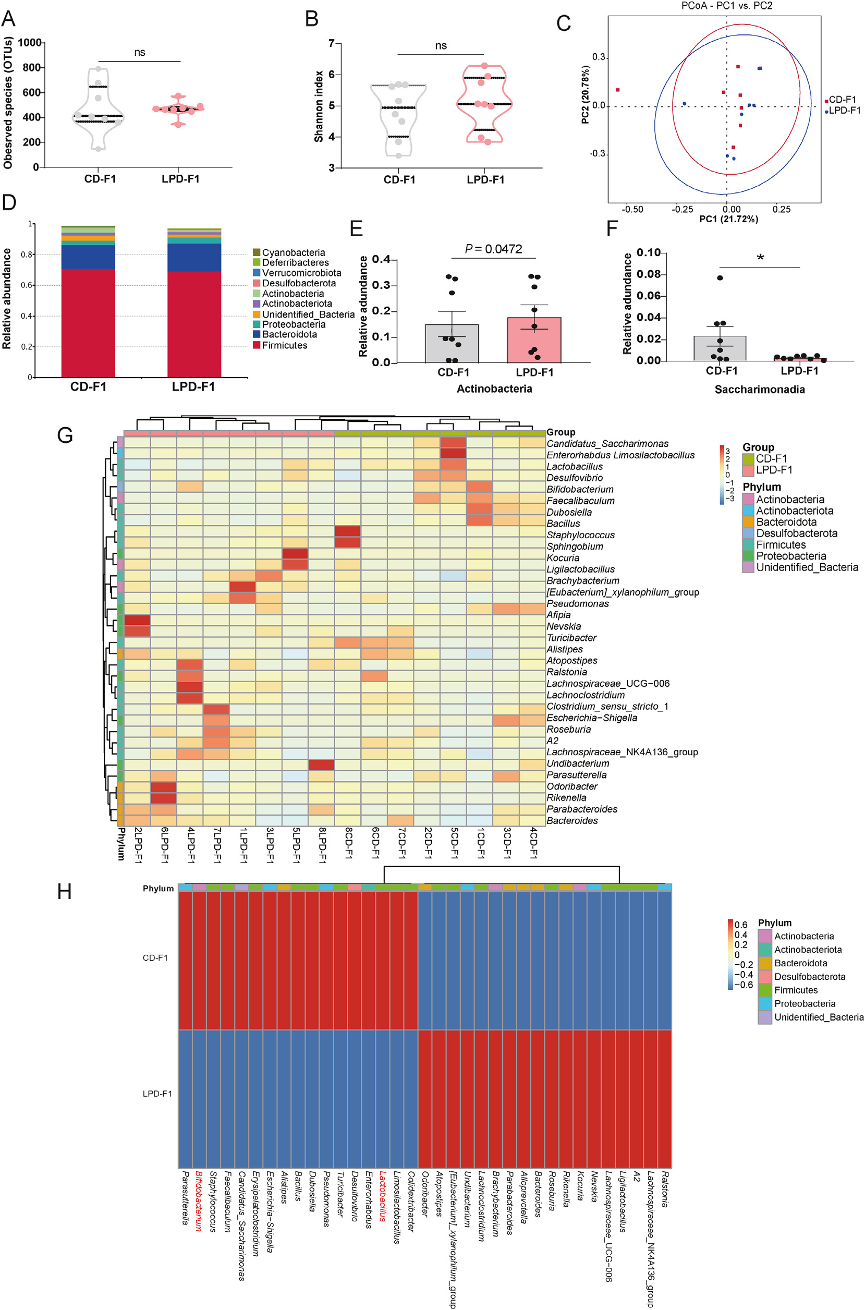
图3:成年LPD-F1子代(12周龄,n=8)的粪便微生物组变化。
(4)LPD-F1卵母细胞中的全基因组高甲基化。
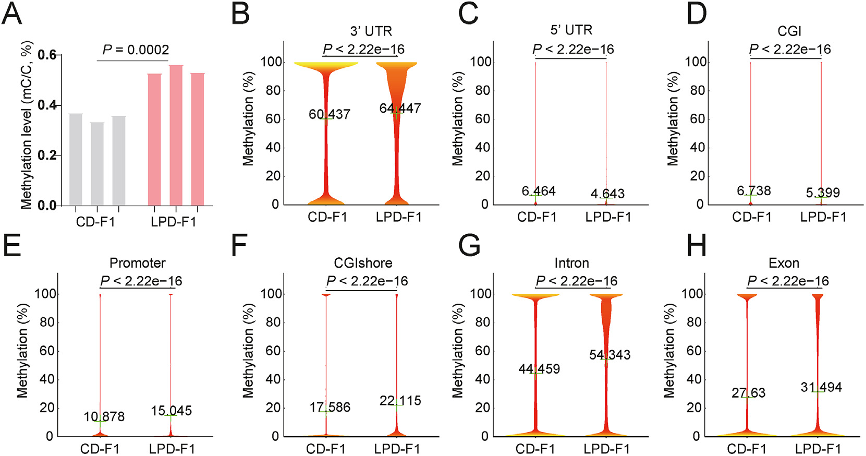
图4:LPD-F1卵母细胞中的整体DNA高甲基化
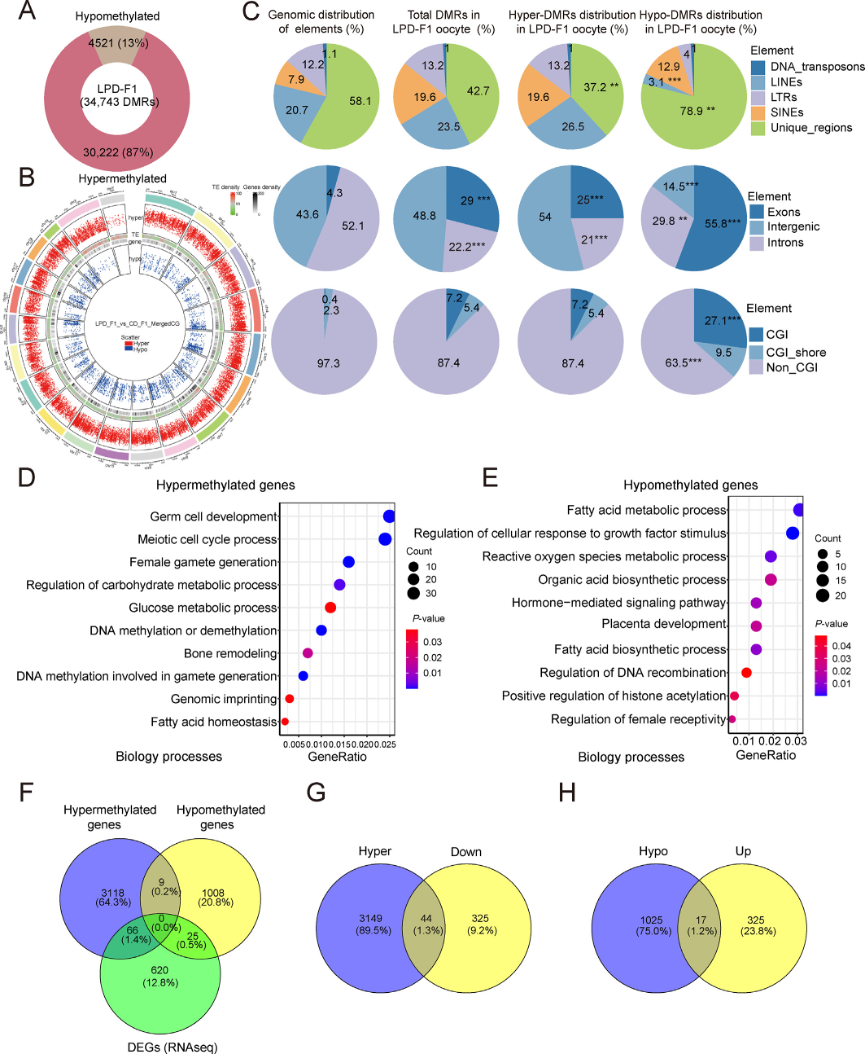
图5:LPD-F1卵母细胞中的差异甲基化区域(DMRs)分析。
A:LPD-F1卵母细胞中低甲基化和高甲基化DMRs比例。
B:DMRs在不同染色体上的分布。
C:饼图显示不同基因组区域中DMRs的分布。
D-E:启动子区高甲基化基因(D)和低甲基化基因(E)的GO分析。
F-H:维恩图表示不同甲基化基因与差异表达基因(DEGs,F)、高甲基化基因与下调基因(G)以及低甲基化基因与上调基因(H)之间的重叠。
DMRs,差异甲基化区域;GO,基因本体论;CGI,CpG岛;LINEs,长散在核元件;LTRs,长末端重复序列;SINEs,短散在核元件。
(5)F1代卵母细胞中变化的DNA甲基化部分传递给F2代卵母细胞。
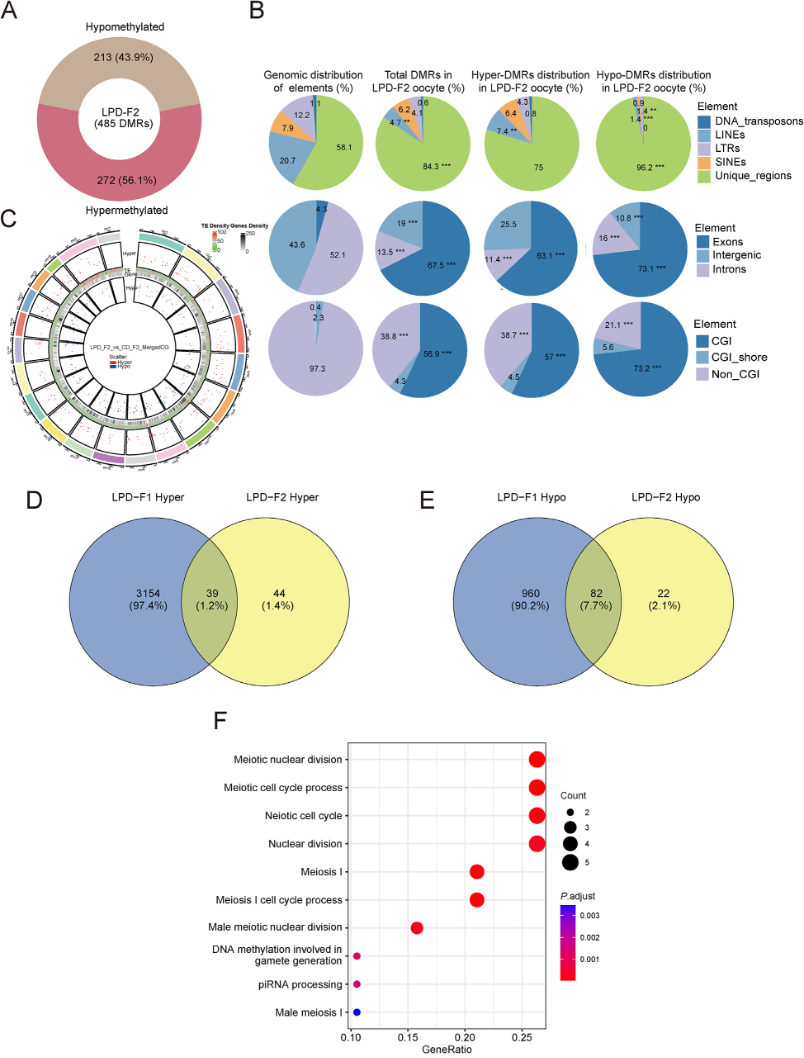
图6:LPD-F2卵母细胞中的差异甲基化区域(DMRs)分析。
A:LPD-F2卵母细胞中低甲基化和高甲基化DMRs比例。
B:DMRs在不同染色体上的分布。
C:饼图显示不同基因组区域中DMRs分布。
D:维恩图展示LPD-F1高甲基化基因与LPD-F2高甲基化基因的重叠。
E:维恩图展示LPD-F1低甲基化基因与LPD-F2低甲基化基因的重叠。
F:LPD-F1与LPD-F2之间重叠高甲基化基因的GO分析。
参考文献:
Gu LJ, Li L, Li QN, Xu K, Yue W, Qiao JY, Meng TG, Dong MZ, Lei WL, Guo JN, Wang ZB, Sun QY. The transgenerational effects of maternal low-protein diet during lactation on offspring. J Genet Genomics. 2024 Apr 22. pii: S1673-8527(24)00079-1. doi: 10.1016/j.jgg.2024.04.008. PubMed PMID: 38657948.