
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
近日,苏州大学第一附属医院/江苏省血液研究所唐雅琼博士等为第一作者、吴德沛教授和韩悦教授为共同通讯作者在《Science Advances》(Sci Adv)杂志发表题为《Hypermethylation of DNA impairs megakaryogenesis in delayed platelet recovery after allogeneic hematopoietic stem cell transplantation》的研究论文。研究聚焦于造血干细胞移植(Hematopoietic Stem Cell Transplantation,HSCT)后延迟血小板恢复(Delayed Platelet Recovery,DPR)这一复杂并发症,揭示了在DPR患者体内,造血干细胞(Hematopoietic Stem Cells,HSCs)和巨核细胞祖细胞(Megakaryocyte Progenitor Cells,MKPs)的CG岛区域存在显著高甲基化。经低甲基化药物地西他滨(Decitabine)干预后,可以降低MKPs中甲基化CG水平,并在小鼠模型中增强巨核细胞生成。研究还揭示DNA甲基转移酶DNMT3A在巨核细胞系中对巨核细胞生成的负向调控作用,DNMT3A能够直接结合并甲基化ETS1和RUNX1基因,从而影响巨核细胞生成过程。易基因科技为本研究提供多组学技术(包括WGBS、ChIP-seq、RNA-seq测序和分析)服务。

标题:Hypermethylation of DNA impairs megakaryogenesis in delayed platelet recovery after allogeneic hematopoietic stem cell transplantation(DNA高甲基化影响异基因造血干细胞移植后延迟血小板恢复中的巨核细胞生成)
发表时间:2025-05-07
发表期刊:Science Advances
影响因子:IF12.5/Q1
易基因提供技术:WGBS、ChIP-seq、RNA-seq
DOI:10.1126/sciadv.ads3630
易小结
造血干细胞移植(HSCT)后延迟血小板恢复(DPR)是一种常见且预后不良的复杂并发症,其机制尚未完全阐明。
本研究成功展示了多组学整合分析技术(WGBS、ChIP-seq、RNA-seq)在深入解析此类复杂临床问题中的强大效力。通过协同应用这些技术,我们得以跨越单一维度的局限,系统性地揭示DPR患者关键造血细胞群体中表观基因组与转录组的异常特征及其内在联系,从而精准定位核心调控因子及其作用网络。这充分体现了多组学技术在破译疾病分子机制、发现潜在治疗靶点方面的独特优势。
这些发现不仅为理解DPR提供了新视角,更重要的是,有力地提示了多组学整合策略在未来类似临床研究中的普适性价值。该策略有望成为深入探索复杂疾病机制、加速精准诊断标志物发现、以及指导靶向治疗策略(如基于表观遗传调控的干预)开发的关键路径。本研究为运用系统性多组学方法攻克临床疑难问题提供了可借鉴的范例。
研究意义
为DPR这一临床常见且预后不良的并发症提供了新的发病机制解释,即异常DNA甲基化在其中发挥重要作用,填补了该领域在表观遗传学层面研究的空白。
基于对DNA甲基化调控机制的深入理解,为开发靶向DPR的新型治疗策略,如利用低甲基化药物地西他滨等,提供了有力的理论依据,有望改善DPR患者的临床预后。
进一步拓展了对造血干细胞分化过程中表观遗传调控的认识,尤其是巨核细胞生成这一特定细胞系的表观遗传学特征,有助于完善造血干细胞分化调控的理论体系。
研究方法
样本收集与处理:收集接受异基因HSCT后出现DPR的患者骨髓样本,同时在患者造血功能恢复良好(Good Graft Function,GGF)时再次收集骨髓样本作为对照。
细胞培养与诱导分化:体外巨核细胞培养,纯化和分离 HSC、MKP 和巨核细胞。
全基因组重亚硫酸盐测序(WGBS):从DPR患者和GGF患者的骨髓中分离HSCs和MKPs进行WGBS测序,分析全基因组范围内CG和非CG(CHG和CHH)位点的甲基化修饰情况,以揭示DPR状态下HSCs和MKPs的DNA甲基化特征。
染色质免疫沉淀测序(ChIP-seq):利用抗DNMT3A特异性抗体对HSCs进行染色质免疫沉淀测序,确定DNMT3A在基因组上的结合位点,探究其在巨核细胞生成过程中对基因表达的调控作用。
RNA测序(RNA-Seq):分析不同处理条件下细胞的转录组变化,结合DNA甲基化数据,探究甲基化修饰对基因表达的影响。
动物实验:采用C57BL/6小鼠模型,通过腹腔注射地西他滨或对照溶剂DMSO,观察小鼠血小板计数、巨核细胞多倍体化等指标的变化,评估地西他滨对巨核细胞生成和血小板恢复的促进作用。构建过表达DNMT3A的HSCs移植模型,研究DNMT3A对小鼠移植后血小板恢复的影响。
基因编辑与功能验证:利用慢病毒介导的基因过表达和敲低技术,对CD34+细胞进行DNMT3A基因的编辑,然后在体外培养条件下检测巨核细胞生成情况,包括细胞增殖、分化以及集落形成能力等指标,验证DNMT3A在巨核细胞生成中的功能。
临床样本验证:检测DPR患者和GGF患者骨髓中CD34+ CD41+细胞内ETS1和RUNX1基因的表达水平,验证DNMT3A调控的靶基因在DPR发病过程中的表达差异。
结果图形
(1)DPR患者移植后HSCs和MKPs的DNA高甲基化特征
通过WGBS研究结果表明,与GGF患者相比,DPR患者HSCs和MKPs中CG位点的甲基化水平显著升高,表现为CG岛区域的高甲基化。在染色体分布上,DPR患者HSCs和MKPs的各染色体上均呈现出相对高甲基化状态,且HSCs相比MKPs存在更多的高甲基化区域,但在DPR患者中,巨核细胞调控基因在HSCs和MKPs之间的甲基化差异并不明显。
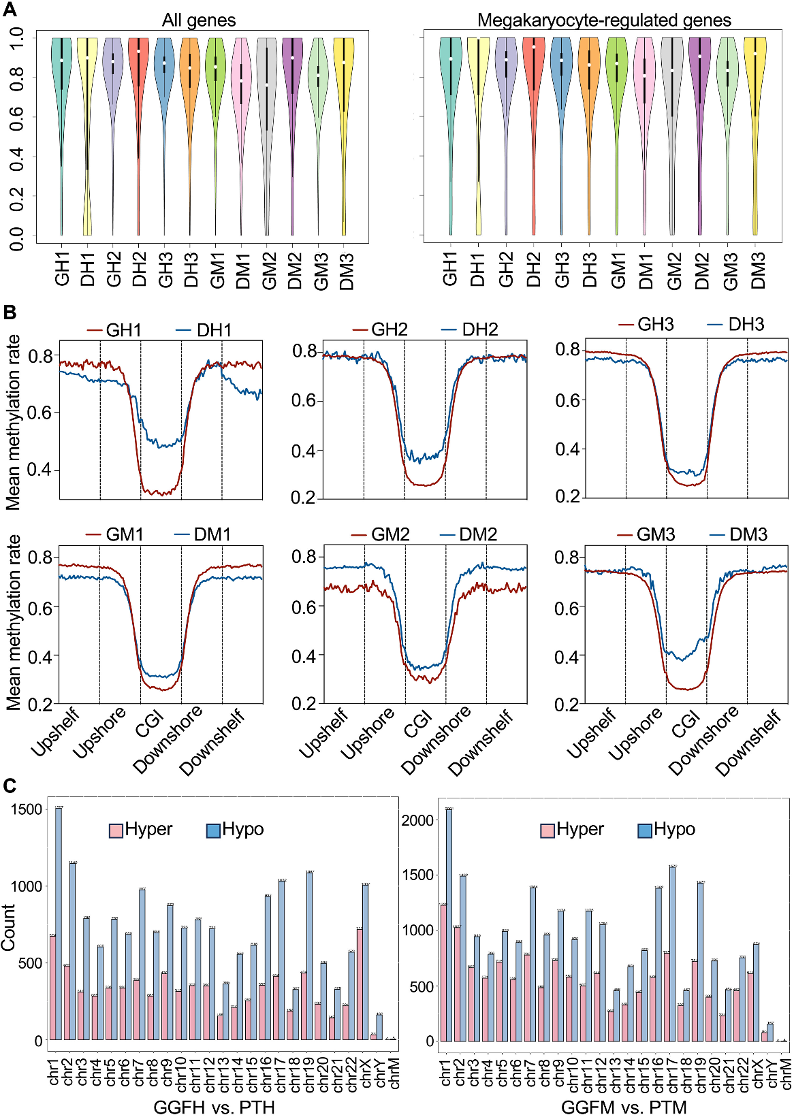
图1:DPR患者移植后HSCs和MKPs的DNA高甲基化情况。
(A)每个样本的甲基化CG。左侧为所有基因;右侧为巨核细胞调节基因。GH1–3表示三例患者处于良好移植功能(GGF)时的HSCs;DH1–3表示三例患者处于DPR时的HSCs;GM1–3指三例患者处于GGF时的MKPs;DM1–3指三例患者处于DPR时的MKPs。
(B)DPR和GGF患者HSCs和MKPs中CG岛的平均甲基化率。
(C)DMRs的染色体分布。X轴表示23对染色体和线粒体染色体;Y轴表示每条染色体的低甲基化和高甲基化DMRs的数量。左侧为GGFH vs PTH;右侧为GGFM vs PTM。GGFH为处于GGF的患者HSCs;PTH为处于DPR的患者HSCs;GGFM为处于GGF的患者MKPs;PTM为处于DPR的患者MKPs。
(2)低甲基化药物地西他滨促进巨核细胞增殖和分化,伴随巨核细胞生成过程中的全基因组DNA去甲基化和转录组变化
C57BL/6小鼠经地西他滨干预后,小鼠血小板计数显著增加,巨核细胞多倍体化水平提高,表明巨核细胞成熟度改善,而MKPs数量未见明显差异。体外实验中,地西他滨干预的Meg01细胞中CD41+细胞比例增加。WGBS结果显示,地西他滨干预小鼠的巨核细胞和MKPs中mCG水平降低,而mCH水平在两组间相似,表明地西他滨主要作用于5mC甲基化。主成分分析显示,地西他滨干预组与对照组在CG甲基化的CpG位点和DMRs上存在明显分离。与对照组相比,地西他滨干预组巨核细胞和MKPs中TSS区域及CG岛的CG位点呈现低甲基化状态。在基因表达层面,地西他滨干预组巨核细胞中23,529个基因启动子区域发生低甲基化,其中2136个基因转录水平上调,476个基因下调;480个基因启动子区域发生高甲基化,42个基因转录水平上调,23个基因下调。
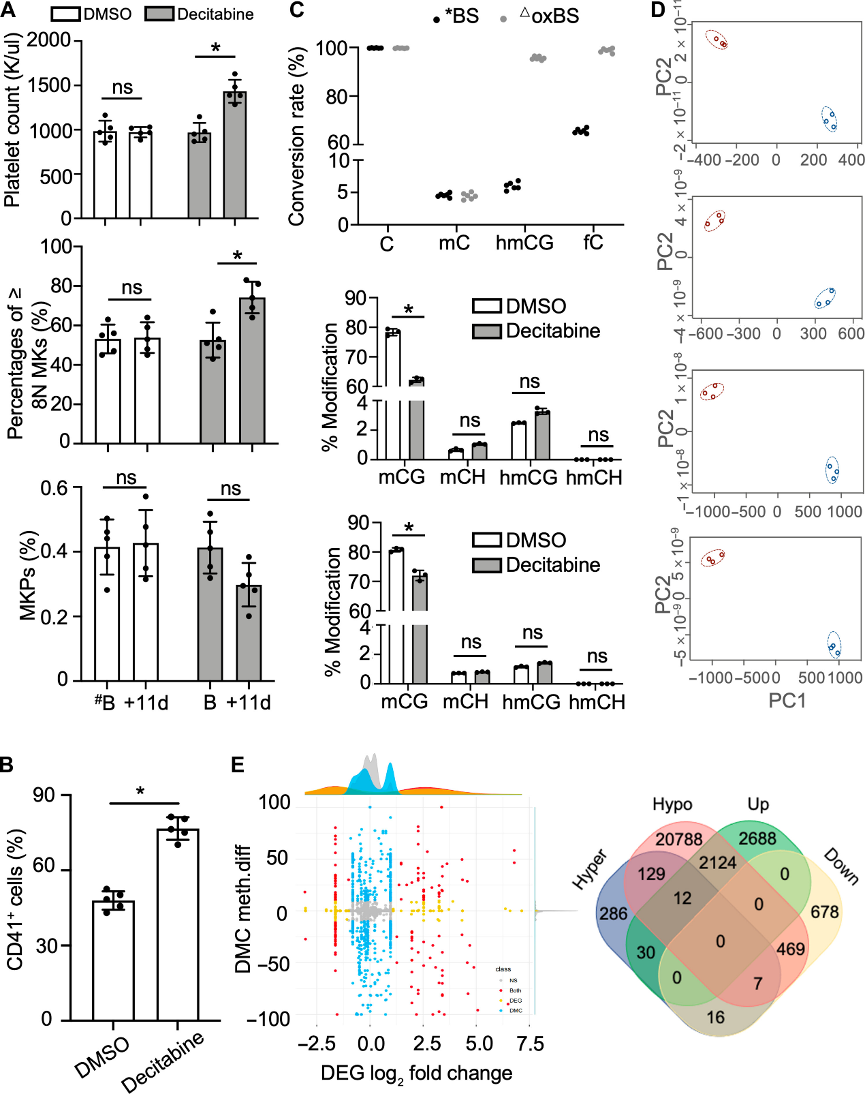
图2:经地西他滨干预后的全基因组DNA去甲基化和转录组变化。
(A)经地西他滨干预的小鼠血小板和多倍体巨核细胞(≥8N)数量增加(上、中),而MKPs无差异(下)。
(B)地西他滨存在下培养Meg01细胞,与DMSO相比,经地西他滨干预的细胞中CD41+细胞比例更高。
(C)每个样本的亚硫酸盐转化率(上)。地西他滨和DMSO组的巨核细胞(中)和MKPs(下)的mCG、mCH、hmCG和hmCH的修饰率。
(D)mCG修饰谱的主成分分析(红色,地西他滨组;蓝色,对照组。从上到下,巨核细胞-CpG,巨核细胞-DMRs,MKPs-CpG,MKP-DMRs)。
(E)差异甲基化胞嘧啶(DMC)甲基化差异与差异表达基因的组合图(左),低甲基化或高甲基化且上调或下调的基因(右)。
(3)DNMT3A负向调控巨核细胞生成
在巨核细胞系中,地西他滨干预后DNMT3A和DNMT1蛋白表达水平降低。体外实验中,DNMT3A敲低促进CD34+细胞向巨核细胞分化,而DNMT3A过表达则抑制巨核细胞生成,这一结果在Meg01细胞系中也得到验证。免疫荧光染色和CFU-MK实验进一步证实了DNMT3A对巨核细胞生成的负向调控作用。在体内实验中,移植过表达DNMT3A的HSCs小鼠出现血小板恢复延迟,而低剂量地西他滨干预可改善这一状况。
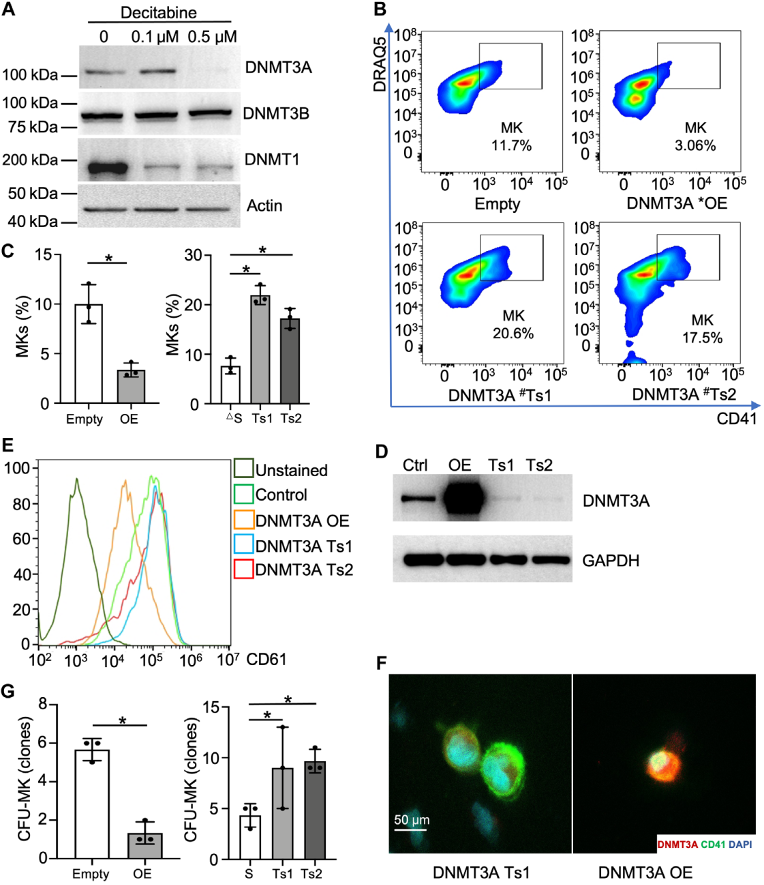
图3:DNMT3A负向调控巨核细胞生成。
(A)通过Western blot检测地西他滨干预后巨核细胞系中DNA甲基转移酶表达。
(B-C)在巨核细胞系诱导培养基中,DNMT3A的敲低和过表达分别促进和抑制巨核细胞生成。
(D)验证过表达和敲低细胞中DNMT3A的表达。
(E) 使用Meg01细胞进行DNMT3A敲低和过表达设置。
(F)对源自DNMT3A敲低和过表达的CD34+细胞的巨核细胞进行免疫荧光染色。
(G) CFU-MK实验表明DNMT3A过表达损害巨核细胞克隆。
(4)DNMT3A在巨核细胞生成过程中直接结合并甲基化ETS1和RUNX1
通过分析GEO数据库和DNMT3A ChIP-seq数据,发现ETS1、RUNX1和KLF3是DNMT3A直接结合并甲基化的靶基因,且这些基因的转录水平发生相应变化。在DPR患者骨髓中,ETS1和RUNX1表达降低,而KLF3水平无差异,提示ETS1和RUNX1可能参与DPR状态下巨核细胞生成的异常调控。
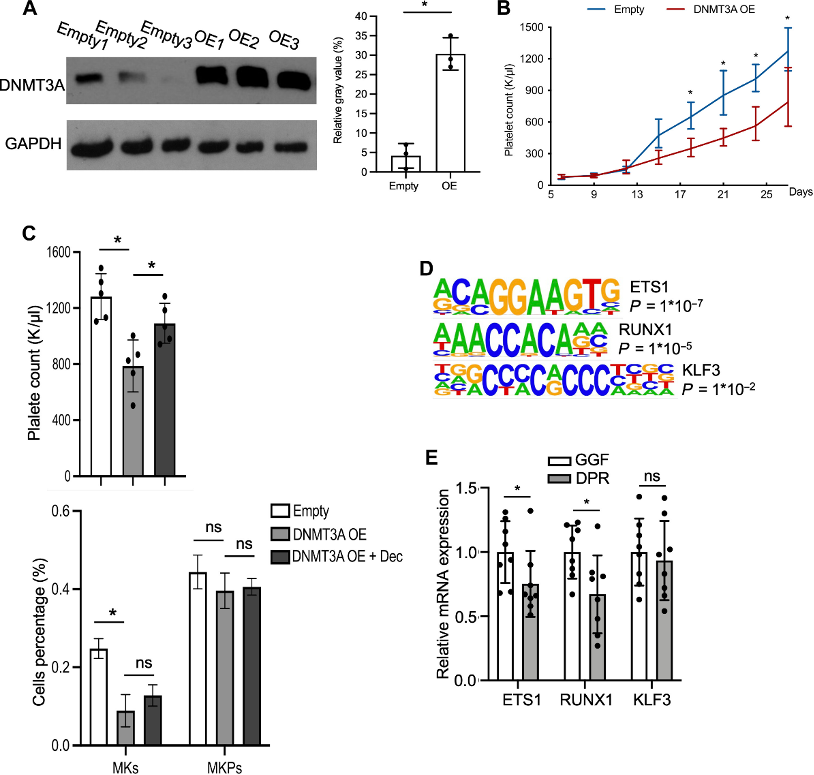
图4:在巨核细胞生成过程中,ETS1和RUNX1被DNMT3A直接结合并甲基化。
(A)在移植了对照组和过表达DNMT3A的HSCs受体小鼠的骨髓细胞中检测DNMT3A表达。
(B)在HSC移植后每3天监测血小板计数。
(C)从移植了对照组和过表达DNMT3A的HSCs以及接受地西他滨干预的受体小鼠中收集骨髓细胞。通过流式细胞术检测MKs和MKPs水平。
(D)DNMT3A ChIP-seq显示ETS1、RUNX1和KLF3被DNMT3A直接结合。
(E)与GGF患者相比,DPR患者CD34+CD41+细胞中ETS1和RUNX1表达降低,KLF3水平无差异。
讨论
本研究通过WGBS深入探讨了DPR患者中HSCs和MKPs的DNA甲基化特征,发现异常的高甲基化模式与巨核细胞生成受损密切相关,为理解DPR的发病机制提供了新的表观遗传学视角。
地西他滨作为一种低甲基化药物,能够有效促进巨核细胞的增殖和分化,其作用机制可能涉及对巨核细胞特异性基因启动子区域的去甲基化,从而调控基因表达,这一发现为DPR治疗提供了新策略。
研究揭示了DNMT3A在巨核细胞生成中的负向调控作用,并通过ChIP-seq技术验证ETS1和RUNX1是DNMT3A的直接靶基因,进一步阐明DNMT3A介导的DNA甲基化在巨核细胞生成过程中的调控机制。
未来的研究可以扩大样本量,深入探究多种表观遗传修饰之间的互作以及其在DPR发生发展中的协同调控作用。同时,结合临床试验进一步验证低甲基化药物在DPR治疗中的安全性和有效性,为临床治疗提供更有力的证据支持。
参考文献:
Tang Y, Song X, Zhang Z, Yao Y, Pan T, Qi J, Xia L, Wu D, Han Y. Hypermethylation of DNA impairs megakaryogenesis in delayed platelet recovery after allogeneic hematopoietic stem cell transplantation. Sci Adv. 2025 May 9;11(19):eads3630. doi: 10.1126/sciadv.ads3630.