大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
近日,华南农业大学动物科学学院Yaoyao Xia、宾朋等为共同第一作者,任文凯教授为唯一通讯作者在《Cell Reports》期刊上发表题为“Glycerophospholipid metabolism licenses IgE-mediated mast cell degranulation”的科研论文。研究主要聚焦免疫球蛋白E(IgE)介导的肥大细胞脱颗粒过程中甘油磷脂代谢的作用机制。研究通过转录组学、代谢组学和脂质组学等多组学联合分析揭示了IgE刺激下肥大细胞的转录和代谢状态变化,特别是甘油磷脂代谢激活及对肥大细胞脱颗粒的作用;此外,研究还利用ChIP-seq技术深入分析了表观遗传修饰在调控相关基因表达中的作用,为理解过敏反应的分子机制提供了新的视角。深圳易基因科技为本研究提供ChIP-seq技术支撑,助力揭示表观遗传调控机制。

标题:Glycerophospholipid metabolism licenses IgE-mediated mast cell degranulation(甘油磷脂代谢:IgE介导肥大细胞脱颗粒的关键调控机制)
发表时间:2025年6月24日
发表期刊:Cell Reports
影响因子:IF6.9/Q1
组学技术:转录组学、代谢组学、脂质组学、表观组学(ChIP-seq)(易基因金牌技术)
合作单位:华南农业大学动物科学学院
DOI:10.1016/j.celrep.2025.115742

IgE抗体和肥大细胞在过敏反应和过敏性休克的病理生理学中起着关键作用。然而,IgE介导肥大细胞脱颗粒的关键机制尚不清楚。本研究发现FcεRI聚集引发的p38α信号通过招募SWI-SNF染色质重塑复合体,促进Ets-1转录,从而调控Pcyt1a表达和甘油磷脂代谢。Pcyt1a介导的甘油磷脂代谢通过改变Prkcd启动子区域的H3K9me3沉积,增强FcεRI的有限巨噬细胞吞噬作用,从而促进肥大细胞脱颗粒。此外,该代谢通路在小鼠模型、人类疾病研究的生信分析和临床样本检测中,均验证通过其可触发过敏性疾病(如特应性皮炎)。总之,本研究证实脂质代谢和p38α信号调控肥大细胞激活,并为临床治疗过敏性疾病提供潜在治疗靶点。
研究亮点
染色质重塑引发Ets-1转录,从而调控Pcyt1a表达。
Pcyt1a介导的甘油磷脂代谢支持IgE介导的肥大细胞脱颗粒。
磷酸胆碱(phosphorylcholine,P-choline)和磷脂酰胆碱(Phosphatidylcholine,PC)通过依赖H3K9me3的限制性巨噬细胞吞噬作用增强FcεRI信号。
针对甘油磷脂代谢的干预可减轻与肥大细胞相关的疾病。
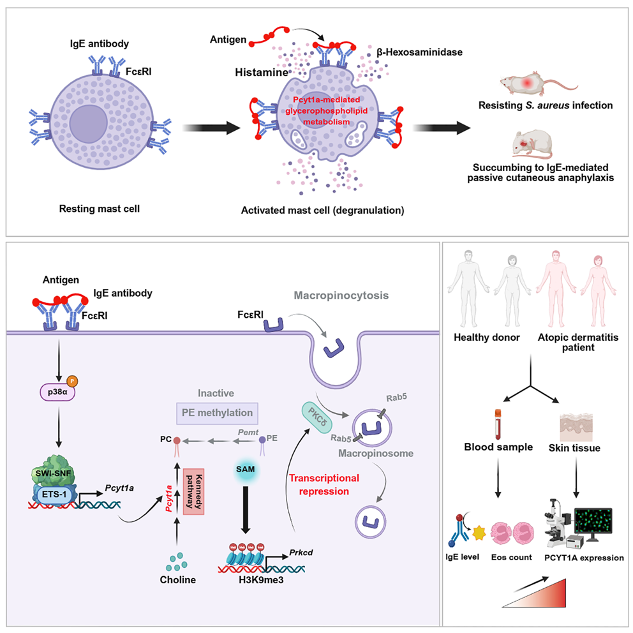
研究摘要
研究方法
细胞培养与处理:利用小鼠骨髓细胞培养生成骨髓来源的肥大细胞(BMMCs),并用IgE刺激以模拟过敏反应。
转录和代谢组学分析:结合转录组学、代谢组学和脂质组学方法,分析IgE刺激下肥大细胞的转录和代谢变化。
表观组学基因表达调控分析:ChIP-seq技术分析组蛋白修饰(H3K9me3)在Pcyt1a等关键基因启动子区域的分布,揭示表观遗传调控机制。
功能验证实验:利用基因沉默、过表达和药物抑制等方法,验证关键基因和代谢产物在肥大细胞脱颗粒中的作用。
动物模型实验:通过小鼠模型验证Pcyt1a介导的甘油磷脂代谢在体内对肥大细胞激活的作用。
结果图形
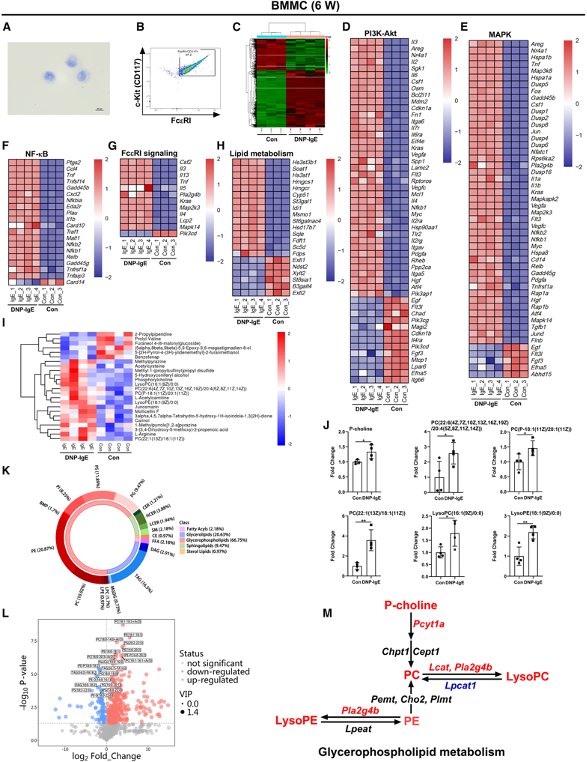
(1)IgE刺激的肥大细胞具有特异性转录和代谢状态
研究首先通过转录组学分析发现IgE刺激的肥大细胞表现出与静息时显著不同的转录状态,有1,545个基因显著上调,858个基因显著下调。这些基因主要富集在PI3K-Akt、MAPK、NF-κB和FcεRI信号通路中。代谢组学分析显示,IgE刺激的肥大细胞中甘油磷脂代谢显著上调,特别是磷脂酰胆碱(PC)和磷酸胆碱(P-choline)水平显著增加。这些结果表明IgE刺激的肥大细胞具有独特的转录和代谢特征,为后续研究提供了基础。
图1:IgE刺激的肥大细胞具有特异性转录和代谢状态
(A) 骨髓来源的肥大细胞(BMMCs,6周)的甲苯胺蓝染色分析(n=6)。
(B) 通过细胞表面标记c-Kit(CD117)和FcεRI的流式细胞术分析BMMCs(6周)纯度(n=3)。
(C) 未处理的BMMCs(“对照组”)和DNP-IgE刺激的BMMCs(“DNP-IgE组”)进行上调(红色)或下调基因(绿色)热图(n=3–4)。
(D–H) BMMCs中与PI3K-Akt(D)、MAPK(E)、NF-κB(F)、FcεRI信号(G)和脂质代谢(H)相关的上调(红色)或下调基因(蓝色)热图(n=3–4)。
(I) BMMCs中不同代谢物热图(n=4)。
(J) 对照组和DNP-IgE组BMMCs中选定代谢物水平(n=4)。
(K) 差异表达的脂质类别和甘油磷脂种类环状图(n=4)。
(L) BMMCs中不同代谢物的火山图(n=4)。
(M) 甘油磷脂代谢选定代谢物示意图。
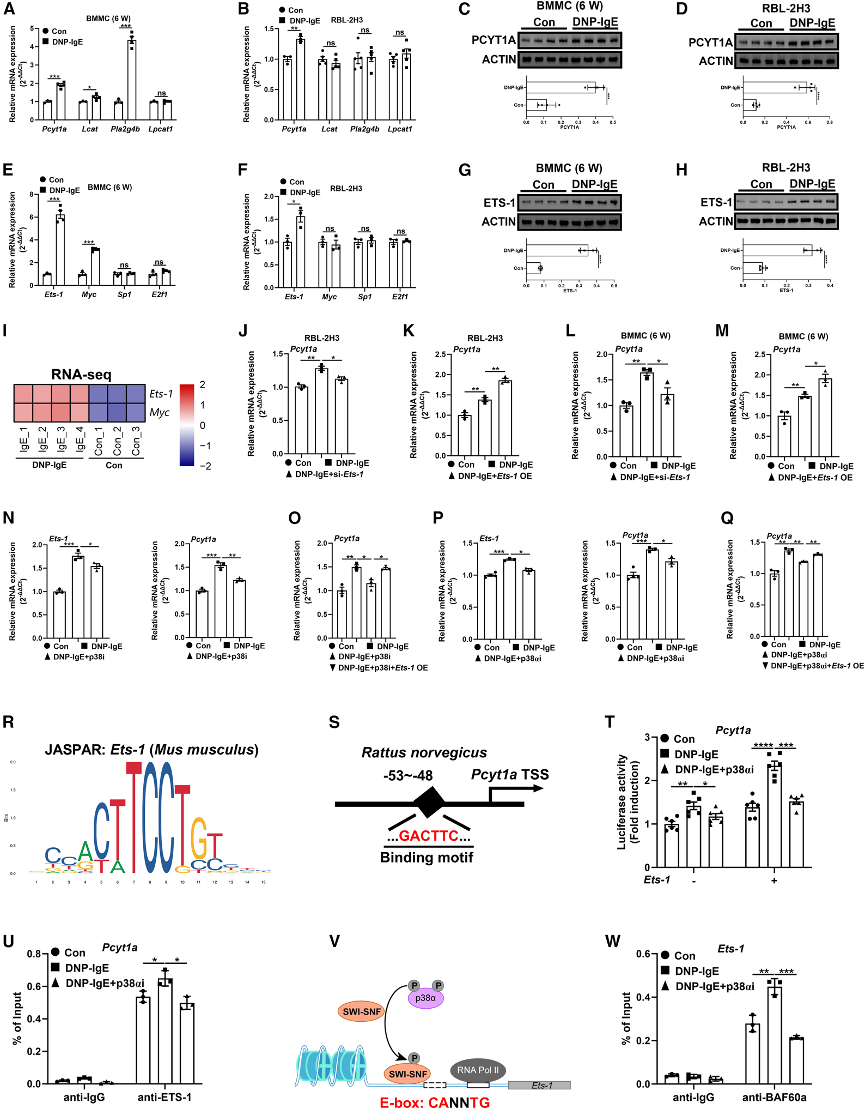
(2)Ets-1支持IgE刺激的肥大细胞中Pcyt1a高表达
研究发现Ets-1在IgE刺激的肥大细胞中显著上调,并通过ChIP-qPCR分析验证Ets-1能够与Pcyt1a基因的启动子区域结合,促进其转录。此外,通过基因沉默和过表达实验验证了Ets-1对Pcyt1a表达的调控作用。这些结果表明Ets-1是Pcyt1a表达的关键转录因子,通过调控Pcyt1a表达影响甘油磷脂代谢。
图2:Ets-1支持IgE刺激的肥大细胞中Pcyt1a高表达
(A-B) 对照组和DNP-IgE组的BMMCs(A)和RBL-2H3细胞(B)中Pcyt1a、Lcat、Pla2g4b和Lpcat1的mRNA表达。
(C-D) 对照组和DNP-IgE组的BMMCs(C)和RBL-2H3细胞(D)中Pcyt1a的蛋白丰度。
(E-F) 对照组和DNP-IgE组的BMMCs(E)和RBL-2H3细胞(F)中Ets-1、Myc、Sp1和E2f1的mRNA表达。
(G-H) 对照组和DNP-IgE组的BMMCs(G)和RBL-2H3细胞(H)中Ets-1的蛋白丰度。
(I) 根据BMMCs的RNA-seq数据,对Ets-1和Myc的表达进行热图分析。
(J、L) 在指定处理条件下,RBL-2H3细胞(J)和BMMCs(L)中Pcyt1a的mRNA表达。
(K、M) 在指定处理条件下,RBL-2H3细胞(K)和BMMCs(M)中Pcyt1a的mRNA表达。
(N) 在指定处理条件下,RBL-2H3细胞中Ets-1(左)和Pcyt1a(右)的mRNA表达。
(O) RBL-2H3细胞中Pcyt1a的mRNA表达。
(P) 在指定处理条件下,RBL-2H3细胞中Ets-1(左)和Pcyt1a(右)的mRNA表达。
(Q) RBL-2H3细胞中Pcyt1a的mRNA表达。
(R、S) 通过JASPAR分析Pcyt1a转录起始位点(TSS)的结合位点模式。
(T) 在RBL-2H3细胞中,Ets-1与Pcyt1a启动子结合的双荧光素酶报告分析。
(U) 通过ChIP-qPCR分析Ets-1在RBL-2H3细胞中Pcyt1a启动子的占有率。
(V) p38α介导SWI-SNF染色质重塑复合体招募以调节Ets-1转录因子激活示意图。
(W) 通过ChIP-qPCR分析BAF60a在RBL-2H3细胞中Ets-1启动子的占有率。
(3)甘油磷脂代谢调控IgE介导的肥大细胞脱颗粒
研究通过一系列实验验证了Pcyt1a介导的甘油磷脂代谢在IgE介导的肥大细胞脱颗粒中的关键作用。实验显示,Pcyt1a或Ets-1的过表达能够显著增加肥大细胞脱颗粒过程中组胺和β-己糖胺酶释放,而Pcyt1a或Ets-1的沉默则抑制这一过程。这些结果表明甘油磷脂代谢通过调控Pcyt1a表达影响肥大细胞的激活和脱颗粒。
图3:Pcyt1a介导的甘油磷脂代谢调控IgE介导的肥大细胞脱颗粒
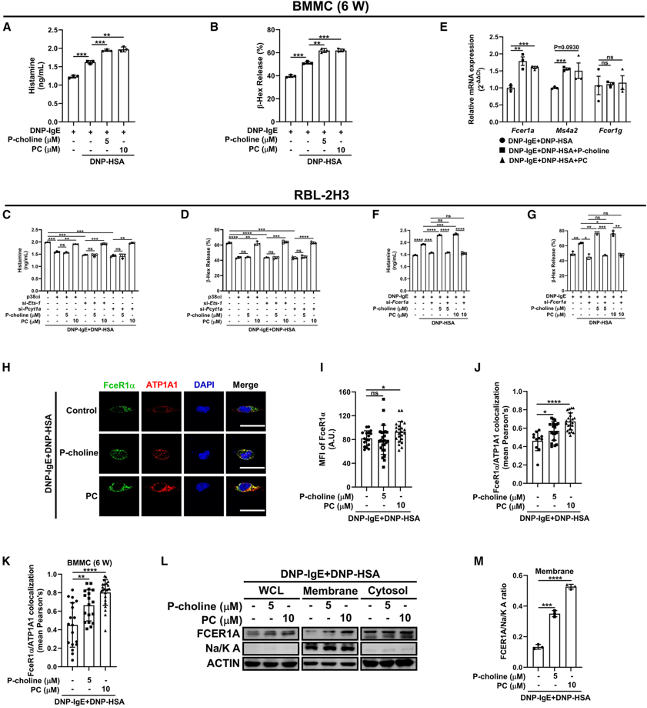
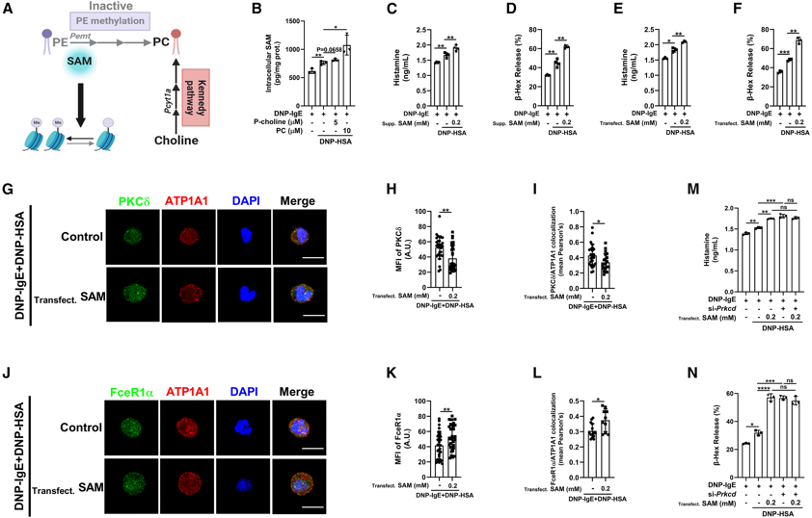
(4)磷酸胆碱(P-choline)和磷脂酰胆碱(PC)通过限制巨噬细胞吞噬作用增强FcεRI信号
研究发现磷酸胆碱(P-choline)和磷脂酰胆碱(PC)能够显著增强IgE刺激的肥大细胞脱颗粒,且这种增强作用依赖于FcεRI信号通路。进一步的实验表明,P-choline和PC通过减少PKCδ的表达和膜转位,限制了巨噬细胞吞噬作用,从而增强了FcεRI信号。这些结果揭示了P-choline和PC在肥大细胞激活中的重要作用。
图4:磷酸胆碱和磷脂酰胆碱通过限制巨噬细胞吞噬作用增强FcεRI信号
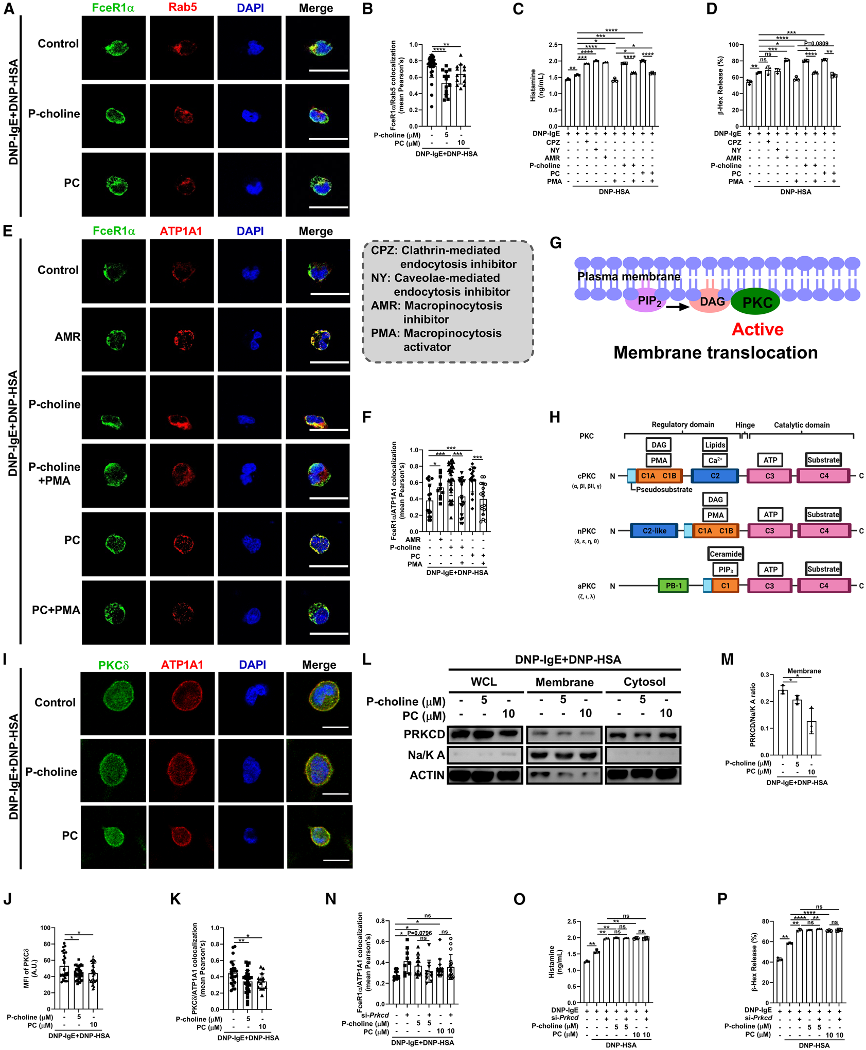
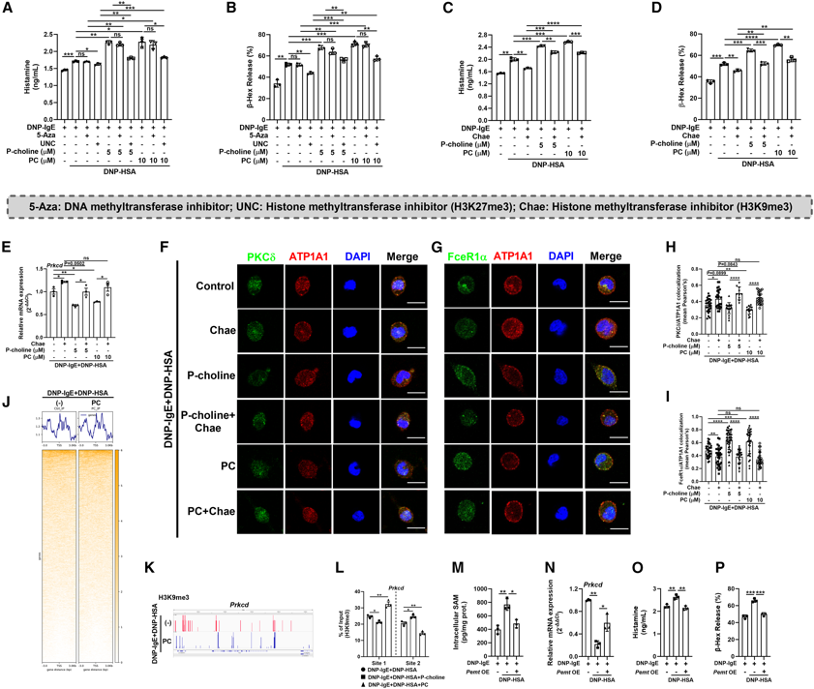
(5)磷酸胆碱(P-choline)和磷脂酰胆碱(PC)促进Prkcd启动子区域H3K9me3沉积,降低巨噬细胞吞噬作用
通过ChIP-seq分析,研究发现磷酸胆碱(P-choline)和磷脂酰胆碱(PC)能够显著增加Prkcd基因启动子区域的H3K9me3沉积,从而抑制Prkcd基因表达。Prkcd编码的PKCδ是巨噬细胞吞噬作用的关键调控因子,其表达下调导致巨噬细胞吞噬作用降低。这些结果表明P-choline和PC通过表观遗传机制调控Prkcd表达,影响肥大细胞的激活。
图5:S–腺苷甲硫氨酸(S-adenosylmethionine,SAM)概括了磷酸胆碱(P-choline)和磷脂酰胆碱(PC)对IgE介导的肥大细胞脱颗粒的影响
图6:磷酸胆碱(P-choline)和磷脂酰胆碱(PC)促进Prkcd启动子区域H3K9me3沉积以降低巨噬细胞吞噬作用
(A、B) 在RBL-2H3细胞中,组胺(A)和β-己糖胺酶(B)的释放。
(C、D) 在RBL-2H3细胞中,组胺(C)和β-己糖胺酶(D)的释放。
(E) RBL-2H3细胞中PKCδ的mRNA表达。
(F、G) RBL-2H3细胞的共聚焦显微镜图像:PKCδ(绿色)和ATP1A1(红色)(F)(10–28个细胞);FceR1α(绿色)和ATP1A1(红色)(G)(26–46个细胞)。
(H、I) RBL-2H3细胞中PKCδ/ATP1A1(H)(10–28个细胞)或FceR1α/ATP1A1共定位(I)直方图。
(J) 平均值图和热图显示ChIP-seq数据集中TSS处H3K9me3的富集情况。
(K) IGV图显示Prkcd基因位点的信号。
(L) 对RBL-2H3细胞中Prkcd启动子区域H3K9me3占有率的ChIP-qPCR分析。
(M) RBL-2H3细胞内SAM的水平(PemtOE,Pemt过表达)。
(N) RBL-2H3细胞中PKCδ的mRNA表达。
(O、P) RBL-2H3细胞中组胺(O)和β-己糖胺酶(P)的释放。
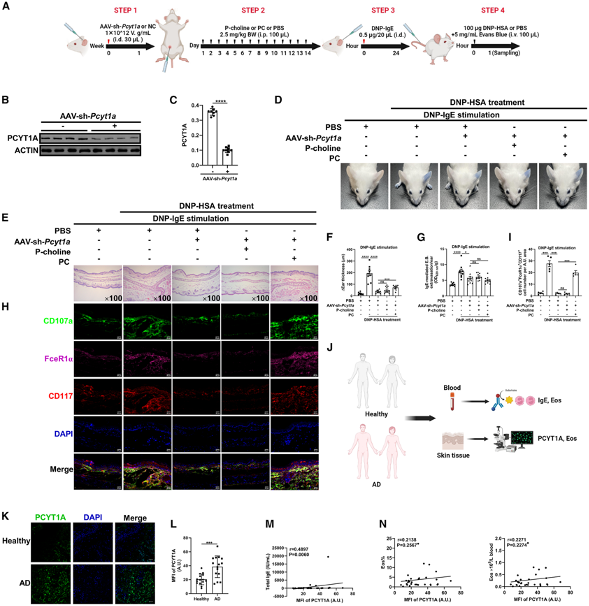
(6)Pcyt1a介导的甘油磷脂代谢在体内改变肥大细胞激活
通过小鼠模型实验,研究验证了Pcyt1a介导的甘油磷脂代谢在体内对肥大细胞激活的影响。实验显示,Pcyt1a基因敲除的小鼠在IgE介导的被动皮肤过敏反应中表现出显著降低的耳肿胀和炎症反应。此外,磷酸胆碱(P-choline)和磷脂酰胆碱(PC)补充能够部分恢复这种抑制效应。这些结果表明Pcyt1a介导的甘油磷脂代谢在体内对肥大细胞激活具有重要作用。
图7:Pcyt1a介导的甘油磷脂代谢在体内改变肥大细胞激活
结论和启示
本研究揭示了Pcyt1a介导的甘油磷脂代谢在IgE介导的肥大细胞脱颗粒中的关键作用,特别是通过表观遗传机制调控Prkcd表达,从而影响巨噬细胞吞噬作用。这些发现为理解过敏反应的分子机制提供了新的视角,并为开发靶向过敏性疾病的新型治疗策略提供了潜在的靶点。
ChIP-seq技术在本研究中发挥了重要作用,通过分析组蛋白修饰在关键基因启动子区域的分布,揭示了表观遗传调控机制。未来类似研究可以利用ChIP-seq技术深入探讨免疫细胞功能的表观遗传调控,为疾病治疗提供新的思路。
参考文献:
Xia Y, Bin P, Zhou Y, Zhao M, Zhang J, Zhong W, Wang N, Wang B, Ren W. Glycerophospholipid metabolism licenses IgE-mediated mast cell degranulation. Cell Rep. 2025 May 20;44(6):115742. doi: 10.1016/j.celrep.2025.115742.