
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
2025年11月19日,山东大学基础医学院艾康博士为第一作者,山东大学基础医学院李雷教授和中国医学科学院血液病医院王璐研究员为共同通讯作者, 合作研究了脊椎动物胚胎发育中造血干细胞和祖细胞(HSPCs)的表观遗传调控机制。具体而言,研究团队以斑马鱼为模型,结合微量全基因组亚硫酸盐测序(WGBS)和转录组测序(RNA-seq)技术,系统解析了DNA甲基转移酶Dnmt3ba在造血内皮细胞(HECs)向HSPCs转化(EHT)过程中的核心作用。
研究发现,Dnmt3ba通过调控整联蛋白(integrin)(itga3b和itga7)的DNA甲基化水平,影响下游Akt/Mdm2/P53信号通路,从而维持造血内皮细胞(HEC)存活,保障HSPC正常发育。研究团队进一步在诱导多能干细胞(iPSC)来源的人造血分化体系中验证了DNMT3B功能的高度保守性,揭示了"Dnmt3ba-Integrin-Akt-Mdm2-P53"轴作为调控EHT的关键表观遗传-信号转导耦合机制。该研究不仅深化了对HSPC发育调控网络的理解,也为体外功能性HSC的生成提供了新的靶点和策略。相关研究成果以“DNA methyltransferase Dnmt3ba-mediated epigenetic modulation of Integrin signaling is essential for hematopoietic stem and progenitor cell development”为题发表于《Communications Biology》期刊。易基因科技为本研究提供微量WGBS技术服务助力揭示DNA甲基转移酶Dnmt3ba在斑马鱼造血干细胞和祖细胞发育中的关键作用。

(DOI:10.1038/S42003-025-09003-W)
本研究证明了在造血内皮细胞(HECs)中高表达DNA甲基转移酶3ba(Dnmt3ba)在斑马鱼中对调控HEC存活具有关键作用。Dnmt3ba缺失导致itgα3b和itgα7位点发生低甲基化,降低了整联蛋白表达以及下游Akt信号传导和Mdm2磷酸化,同时通过上调P53活性触发HEC凋亡。同时,研究者在iPSC来源的人造血分化系统中进行DNMT3B处理发现功能保守性。总体而言,本研究揭示了由Dnmt3ba通过表观遗传调控整联蛋白(integrin)信号来协调HEC存活。

易小结
本研究填补了DNA甲基化在造血内皮细胞向HSPC转化(EHT过程)中的调控机制,阐明了Dnmt3ba特异性通过基因体甲基化激活整联蛋白(integrin)信号的表观调控路径。,也为体外定向诱导功能性HSC提供了新靶点(如DNMT3B-Integrin轴),对造血疾病治疗和再生医学具有重要潜在价值。
研究成功应用易基因金牌微量WGBS技术(仅需约5000个FACS分选的HECs),突破了传统WGBS的细胞高数量限制,为稀有样本DNA甲基化图谱绘制提供了新思路。为今后发育生物学、肿瘤微环境及干细胞研究中的稀有细胞表观遗传学研究奠定了基础。
研究方法
1、模型构建:
l 斑马鱼胚胎:CRISPR/Cas9构建dnmt3ba、itga3b、itga7突变体,Morpholino(MO)敲低基因表达,双荧光标记系特异性标记内皮细胞(ECs)和HECs。
l 人iPSC造血分化模型:模拟人确定性造血过程,验证基因功能保守性。
2、功能挽救实验:
l 热激诱导表达:构建全长和缺失DNA甲基转移酶结构域质粒,通过Tol2转座酶系统整合至基因组。24 hpf热激1小时诱导表达,评估36 hpf时HSPC标记cmyb恢复情况。
l 内皮特异性挽救:使用fli1a启动子驱动dnmt3ba在ECs中特异性表达,验证细胞自主性。
3、多组学分析:
l 微量WGBS:对分选的HEC(约5000细胞)进行全基因组甲基化测序,识别差异甲基化区域(DMRs)。 重点分析启动子(转录起始位点上游2 kb)和基因体(gene body)区域的DMRs。
l RNA-seq:Smart-seq2方法分析HEC转录组,整合WGBS数据挖掘甲基化-表达关联基因。
4、功能验证:
l 体外激活Akt信号(AKT2 CA mRNA)或抑制P53(p53 MO),挽救HEC凋亡表型。
l TUNEL染色、Western blot、qRT-PCR验证细胞凋亡和信号通路变化。
l 人源验证:在iPSC分化体系中敲低DNMT3B,通过流式细胞术评估iHSPC生成效率。
研究结果
(1)Dnmt3ba在斑马鱼造血内皮细胞中特异性富集
通过全胚胎原位杂交(WISH)和荧光激活细胞分选(FACS)结合qRT-PCR,发现dnmt3ba在斑马鱼胚胎25-48 hpf阶段特异性表达于背主动脉(VDA)的造血内皮细胞(HEC),72 hpf时在尾侧造血组织(CHT)富集。FACS分选kdrl+runx1+ HEC证实其表达显著高于普通内皮细胞,提示Dnmt3ba在HEC发育中的潜在特异性功能。值得注意的是,dnmt3ba在原始红细胞、动脉发育及神经元中无明显表达,表明其功能具有细胞类型特异性。该结果为后续功能研究提供了精确的时空定位基础,也引出了核心科学问题:Dnmt3ba如何通过表观遗传重编程决定HEC的命运抉择。
(2)Dnmt3ba对斑马鱼HSPC发育至关重要
使用MO敲低或CRISPR/Cas9突变dnmt3ba后,HEC(runx1+cmyb+)和HSPC(kdrl+CD41*+)数量在VDA区域显著减少,但原始红细胞生成、血管发育未受影响。实时成像显示突变体EHT过程中HEC转化效率降低,证实Dnmt3ba特异性调控HEC存活而非早期定向。这一系列实验确立了Dnmt3ba作为EHT关键调控因子的地位,且其作用窗口特异于HEC向HSPC转化的关键阶段。
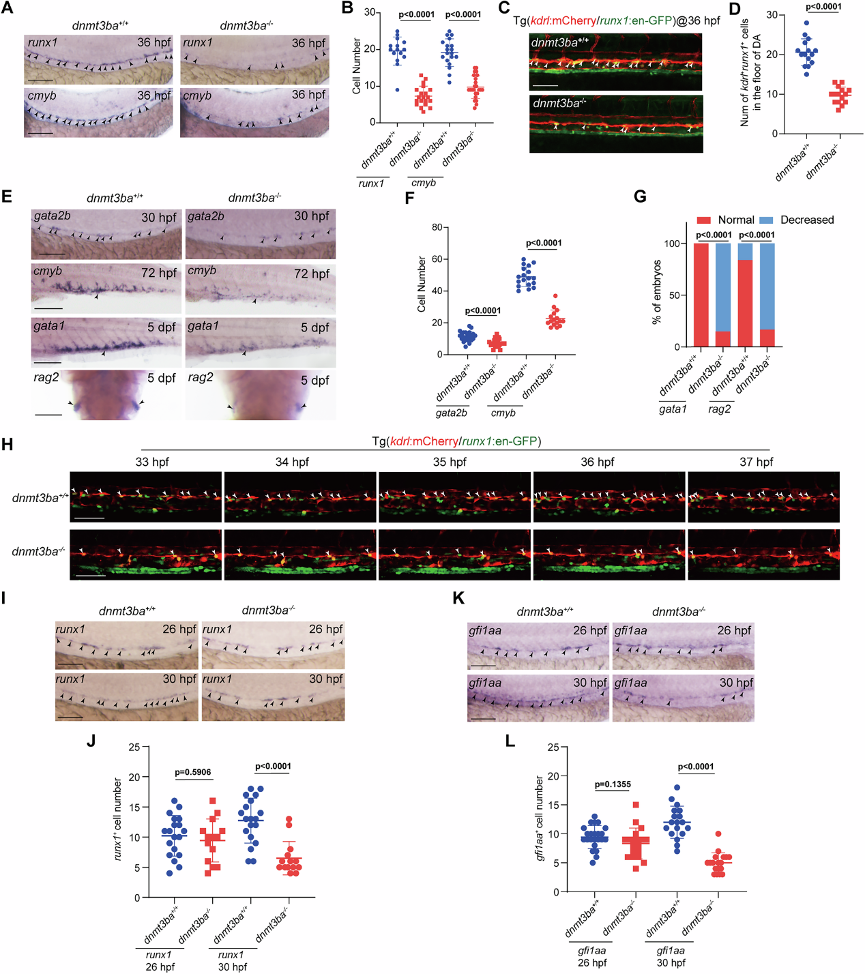
图1:Dnmt3ba对EHT和HSPC发育至关重要
(3)Dnmt3ba的DNA甲基转移酶活性是HSPC发育的关键
使用DNMT3B抑制剂Nanaomycin A处理胚胎或构建甲基转移酶结构域缺失突变体(dnmt3baΔDCM),均导致HSPC标志物cmyb表达下降(图2)。挽救实验中,仅全长Dnmt3ba可恢复突变体表型,证明其功能依赖甲基化活性。内皮特异性挽救部分恢复HSPC生成,表明Dnmt3ba在ECs中自主发挥作用。这些发现共同确立了Dnmt3ba通过其催化活性调控HSPC发育的分子基础,为后续探索其下游靶基因提供了因果链。
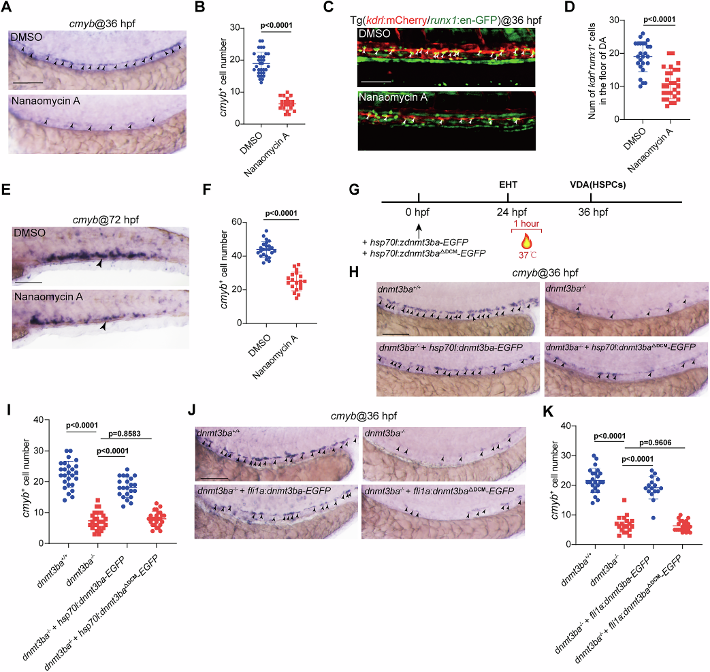
图2:Dnmt3ba的DNA甲基转移酶活性参与HSPC发育
(4)dnmt3ba缺失型造血内皮细胞(HECs)的转录组分析
为解析Dnmt3ba调控的分子网络,研究对约5000个分选的HECs进行RNA-seq。差异表达分析鉴定出790个差异表达基因(DEGs)(321个上调,469个下调),提示Dnmt3ba主要作为转录激活因子。KEGG富集分析揭示下调基因显著富集于"ECM-受体互作"和"黏着斑"通路,而上调基因富集于"P53信号通路"和"细胞凋亡"通路,提示Dnmt3ba缺失导致HEC黏附能力受损并触发凋亡程序。qRT-PCR验证促凋亡基因cdkn1a、gadd45bb和casp8的上调,TUNEL实验揭示dnmt3ba-/-胚胎中HEC凋亡率显著升高,证实P53介导的凋亡是表型核心机制,表明Dnmt3ba通过抑制凋亡维持HEC存活。该转录组分析为WGBS靶基因筛选提供了功能线索,特别是将Integrin信号与细胞凋亡关联起来,为后续机制研究指明了方向。
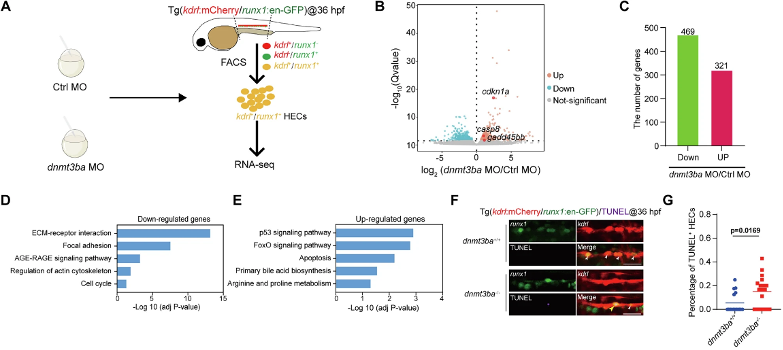
(5)整联蛋白(Integrin)相关基因受Dnmt3ba介导的DNA甲基化调控
对约5000个HECs进行WGBS后,差异甲基化分析显示dnmt3ba突变体中hypo-DMRs数量远超hyper-DMRs,且主要富集于基因体区域,这与DNMT3B在哺乳细胞中偏好活跃转录基因体的特性一致。整合WGBS与RNA-seq数据,筛选出38个基因体低甲基化且表达下调的候选基因,其中itgα3b、itgα7和lamb2显著富集于ECM-受体互作通路。qRT-PCR证实itgα3b和itgα7在dnmt3ba缺失HECs中表达显著降低。为验证甲基化变化,研究使用靶基因甲基化测序对WGBS鉴定的DMRs进行验证:在itgα3b和itgα7基因体CpG岛,dnmt3ba突变体甲基化率较对照组显著下降。更关键的是,对比ECs与HECs发现,野生型HECs中这两个位点的甲基化水平显著高于ECs,表明Dnmt3ba介导的基因体甲基化具有HEC特异性,参与维持itgα3b/itgα7高表达。研究进一步在dnmt3ba-/-胚胎中过表达itgα3b+itgα7双基因,成功挽救HSPC缺失,确立二者为Dnmt3ba下游功能性效应分子。至此,研究建立起"Dnmt3ba→基因体甲基化→itgα3b/itgα7表达→Integrin信号→HSPC发育"的完整因果链。
图3:dnmt3ba缺失的HEC转录组分析
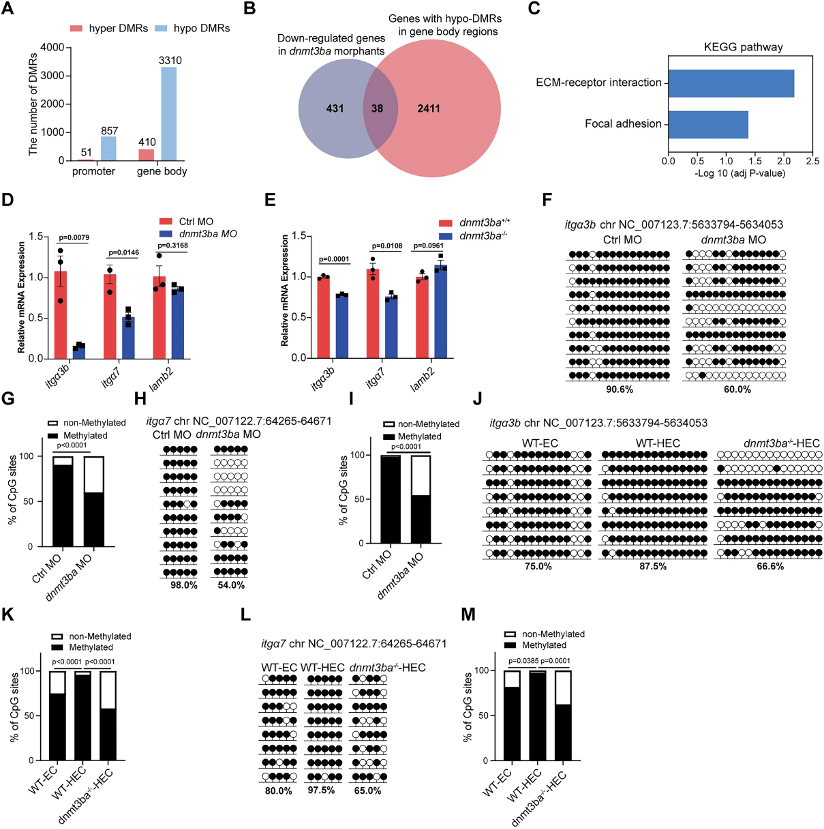
图4:dnmt3ba缺失降低Integrin信号基因的甲基化和表达水平。
(6)Itga3b和Itga7参与Dnmt3ba调控的HSPC发育
敲低或突变itga3b/itga7后,HEC和HSPC数量减少(图5),双敲低呈现协同效应,表明二者功能互补。CRISPR/Cas9构建的itgα3b-/-和itgα7-/-突变体进一步验证了这一结论。挽救实验表明外源表达itga3b/itga7 mRNA可恢复HEC数量和HSPC生成,表明Dnmt3ba通过协同调控两个Integrin α亚基来维持HEC命运。
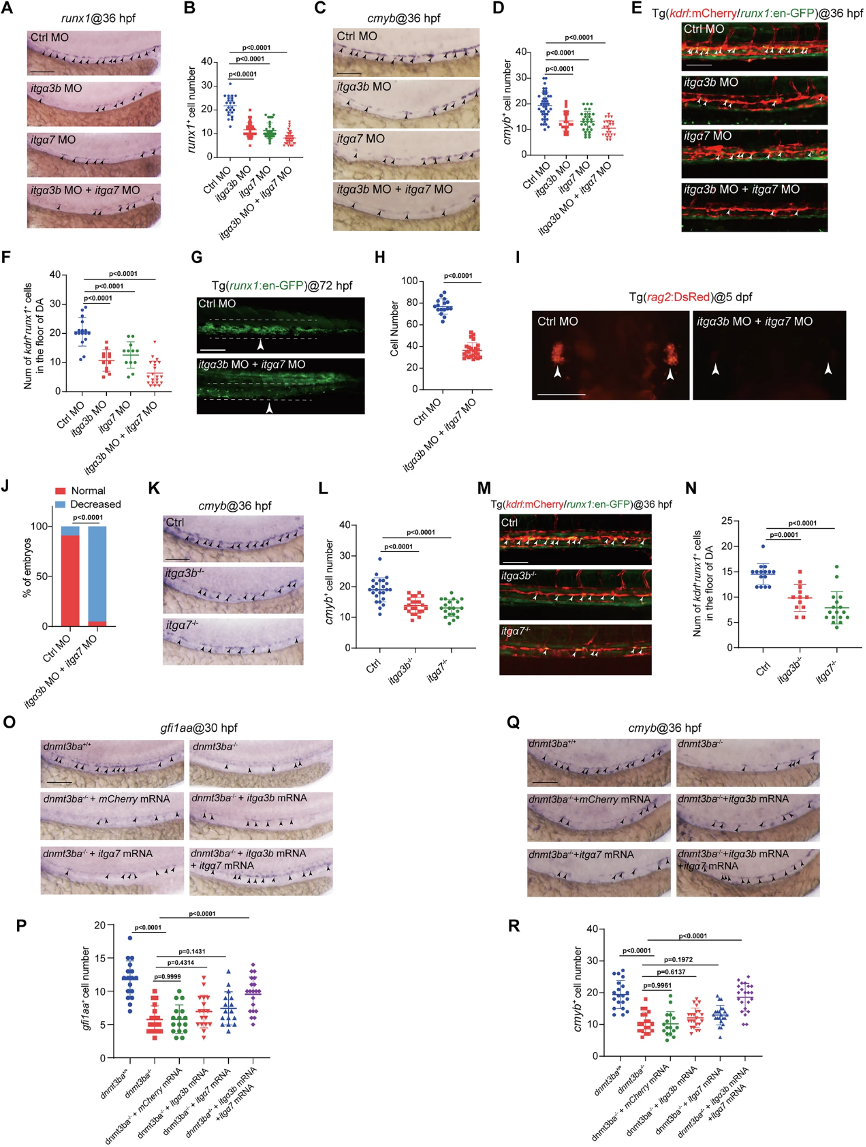
图5:itgα3b/itgα7缺失介导胚胎中HSPC发育障碍。
(7)Dnmtα3b/Integrin/Akt/Mdm2/P53轴调控HEC存活和HSPC发育
机制上,itga3b/itga7缺失抑制Akt磷酸化和Mdm2活化,导致P53积累并引发HEC凋亡(图6A-H)。激活Akt或抑制P53均可挽救dnmt3ba突变体的HSPC缺陷(图6I-M),证实该信号轴是Dnmt3ba调控HEC存活的核心通路。值得注意的是,RNA-seq中FoxO信号通路和细胞骨架调控基因也发生改变,提示可能存在其他平行通路,但Akt-Mdm2-P53轴是核心存活机制。该发现将表观遗传调控与经典信号整合,揭示了EHT过程中"表观-信号-存活"的级联反应,为理解HSPC发育失败提供了完整逻辑链。
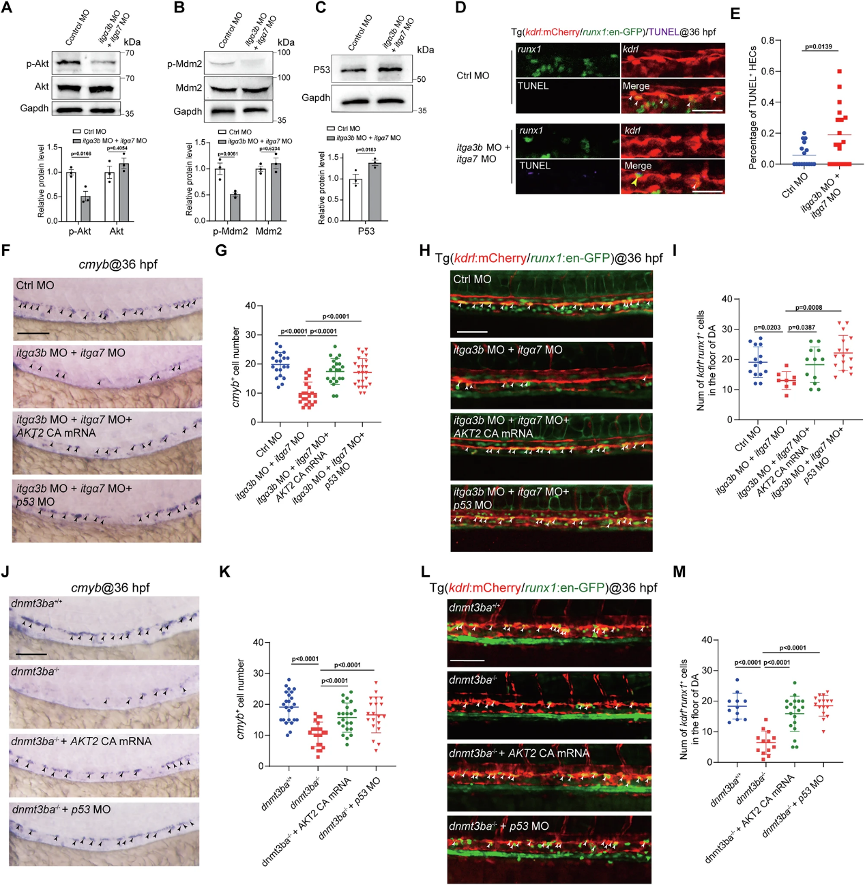
图6:Integrin信号通过调控Akt和P53通路,调控HSPC发育
(8)DNMT3B在人确定性造血发育中的功能保守
跨物种保守性验证是机制研究向临床转化的关键。在人iPSC造血分化体系中,DNMT3B在iHE细胞和iHSPCs中高表达。siRNA敲低DNMT3B后,iHE细胞中ITGA3和ITGA7表达下降,而促凋亡基因CDKN1A、GADD45B、CASP8上调,与斑马鱼表型高度一致。流式分析显示,DNMT3B敲低导致iHSPCs(CD34+CD90+CD49f+CD38-CD45RA-)比例显著降低,表明其功能从斑马鱼到人均保守。这一验证不仅强化了研究结论的普适性,也确立了人EHT过程中"DNMT3B-Integrin-存活信号"轴的存在,为体外HSC生成提供了潜在分子靶点。
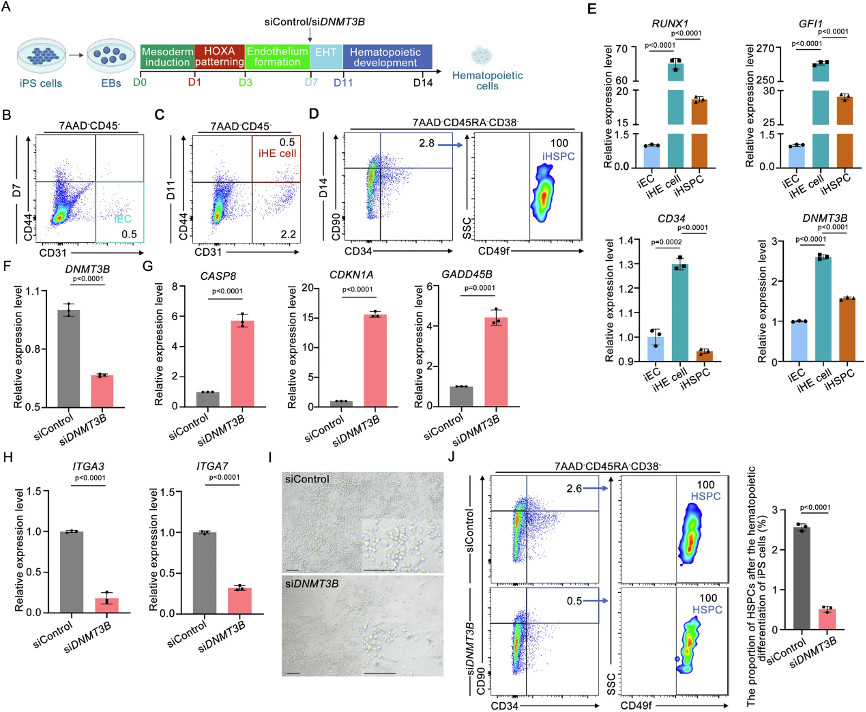
图7:DNMT3B敲低在体外人体iPS细胞造血分化过程中破坏iHSPC生成
结论和启示
本研究系统阐释了Dnmt3ba通过基因体甲基化激活整联蛋白(integrin)信号、维持HEC存活的新机制,强调了不同DNA甲基转移酶(如Dnmt1、Dnmt3bb.1)在HSPC发育中的功能特异性。且DNMT3B-Integrin轴在斑马鱼、小鼠和人中功能保守,是造血谱系的古老调控模块。
微量WGBS技术的应用使在少量细胞中获取高分辨率甲基化图谱成为可能,为表观遗传调控研究提供了技术支撑。未来可探索其他Dnmt3家族成员在造血中的冗余功能,并靶向DNMT3B-Integrin轴优化体外HSC诱导方案。
参考文献:
Ai K, Wu Y, Liang G, Kong H, Yang X, Li N, Liu Z, Dong Y, Xu J, Zhang L, Chen X, Fu Y, Wang L, Li L. DNA methyltransferase Dnmt3ba-mediated epigenetic modulation of Integrin signaling is essential for hematopoietic stem and progenitor cell development. Commun Biol. 2025 Nov 19;8(1):1612. doi: 10.1038/s42003-025-09003-w.