
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
2025年11月24日,安徽医科大学/深圳市第二人民医院徐亚运、安徽医科大学柳文强为共同第一作者,安徽医科大学/深圳市第二人民医院徐亚运、安徽医科大学陈飞虎教授为共同通讯作者,在《INT J BIOL MACROMOL》(IJBM)期刊发表题为“H3K18la-driven methyltransferase 1-mediated upregulation of NeuroD1 m7G modification in promoting ferroptosis resistance in rheumatoid arthritis synovial fibroblasts”的科研成果。研究揭示了代谢-表观遗传-RNA修饰三级调控轴在类风湿关节炎(RA)滑膜成纤维细胞(RASFs)异常增殖中的核心作用。
研究团队发现,RA患者滑液中堆积的乳酸通过组蛋白H3K18乳酸化(H3K18la)修饰激活甲基转移酶METTL1转录;而METTL1介导的m7G RNA甲基化增强了转录因子NeuroD1的mRNA稳定性,进而上调铁死亡关键抑制因子GPX4表达,导致RASFs铁死亡抵抗,最终促进其异常增殖,加剧RA患者关节破坏。该研究整合了代谢组学、表观组学(ChIP-seq、m7G MeRIP-seq)、转录组学(RNA-seq)等多组学技术,在胶原诱导性关节炎(CIA)小鼠模型中验证了靶向METTL1/NeuroD1轴的治疗潜力,为RA的精准干预提供了新的分子靶点和理论依据。易基因科技为本研究提供的m7G MeRIP-seq和RNA-seq技术服务支撑,助力揭示了METTL1通过m7G修饰调控NeuroD1稳定性的直接分子机制。

英文标题:H3K18la-driven methyltransferase 1-mediated upregulation of NeuroD1 m7G modification in promoting ferroptosis resistance in rheumatoid arthritis synovial fibroblasts
中文标题:H3K18乳酸化驱动METTL1介导的NeuroD1 m7G修饰上调促进类风湿关节炎滑膜成纤维细胞铁死亡抵抗
发表时间:2025-11-24
发表期刊:《International Journal of Biological Macromolecules》(IJBM)
影响因子:IF8.5/Q1
技术平台:代谢组学、ChIP-seq、m7G MeRIP-seq、RNA-seq(易基因金牌技术)
作者单位:安徽医科大学、深圳市第二人民医院
DOI:10.1016/j.ijbiomac.2025.149196

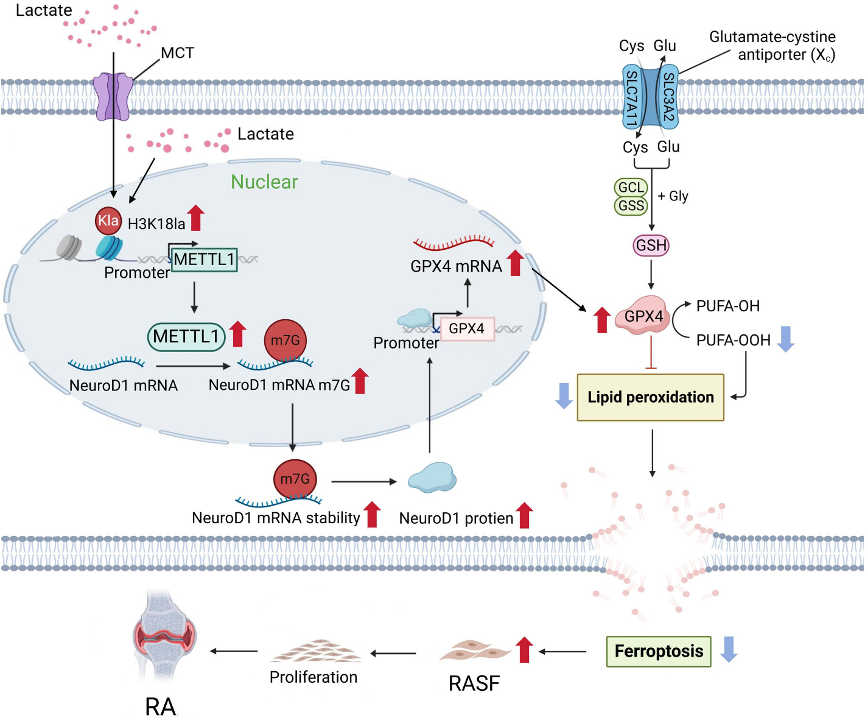
图形摘要:示意图展示H3K18乳酰化如何诱导METTL1介导的NeuroD1 m7G修饰上调,从而增强铁死亡抵抗并促进RASF增殖
易小结
本研究将代谢产物(乳酸)、组蛋白修饰(组蛋白乳酸化)、RNA修饰(m7G甲基化)和铁细胞死亡在RA病理中串联起来,构建了一个全新的致病通路。提出了通过局部干预靶向异常代谢-表观遗传环路,可能实现精准治疗并减少全身副作用的新思路。
研究成功运用代谢组、ChIP-seq、RNA-seq、MeRIP-seq等易基因多组学技术进行机制挖掘,为复杂疾病机制研究提供了思路,凸显了多组学联用在解析RNA修饰功能中的强大能力,为后续类似研究提供了方法学参考。
易基因相关产品拓展性案例展示
l 项目文章|IJBM:安医大陈飞虎团队揭示METTL3介导m6A甲基化在炎症性疾病发病机制中的表观调控作用
l 项目文章|EP/IF7.3:陆军军医大学刘晋祎团队揭示PM2.5暴露通过m6A甲基化调控雄性生殖功能损伤机制
l 项目文章 | 贵州省医刘代顺团队MeRIP-seq揭示m6A修饰在病毒感染中的免疫调控作用
l 项目文章 | MeRIP-seq揭示m6A修饰在肺动脉高压(PAH)发病机制中的潜在作用和新治疗靶点
研究方法
(1)临床样本与细胞模型
样本来源:30例RA患者及30例年龄性别匹配的外伤对照,获取关节滑液和滑膜组织;另取6例RA与6例对照进行非靶向代谢组学分析。
原代细胞:提取原代RASFs和正常滑膜成纤维细胞(NSFs),使用3-6代细胞进行实验。
(2)功能学实验
增殖能力:CCK-8法和EdU染色检测细胞增殖。
铁死亡评估:检测线粒体膜电位、脂质活性氧(ROS)、丙二醛(MDA)水平,并通过透射电镜观察线粒体形态。
双荧光素酶报告基因实验:验证NeuroD1对GPX4启动子的转录激活作用。
(3)分子机制探索
ChIP-seq:使用抗H3K18la抗体富集与H3K18la修饰结合的DNA片段,进行测序分析,鉴定下游靶基因(如METTL1)。ChIP-qPCR定量验证H3K18la在特定基因(如METTL1)启动子区的富集。
m7G甲基化MeRIP-seq:全转录组水平鉴定m7G修饰位点及差异修饰基因。m7G RIP-qPCR定量检测特定RNA(如NeuroD1 mRNA)上的m7G修饰水平。
MeRIP-seq+RNA-seq:将RASFs与NSFs的MeRIP-seq数据与mRNA-seq数据关联分析,筛选出在RASFs中同时发生高m7G修饰且高表达的基因,从而锁定关键下游靶点NeuroD1。
(4)动物模型验证
使用DBA/1小鼠构建胶原诱导性关节炎(CIA)模型。
通过关节内注射携带shMETTL1或shNeuroD1的慢病毒进行局部基因敲低。
评估关节炎指数、体重变化,并进行关节组织的H&E、甲苯胺蓝、SO/FG染色及免疫组化分析,评估治疗效果。
结果图形
(1)类风湿关节炎(RA)患者滑液中堆积的乳酸促进滑膜成纤维细胞(RASFs)增殖
研究首先在临床样本中验证了RA滑膜微环境特征。非靶向代谢组学分析显示,RA患者滑膜液中乳酸水平显著高于关节创伤对照组(图1A-B)。体外实验显示,10 mmol/L乳酸刺激可显著增强RASFs增殖能力,CCK-8检测显示24-96小时存活率持续提升(图1C),EdU阳性率从约15%上升至35%(图1D-E)。
同时,研究发现在RA患者和CIA小鼠模型的滑膜组织中,整体蛋白乳酸化(Pan-Kla)和特异的组蛋白H3K18la水平均显著上调(图1F-K)。细胞水平,RASFs中的H3K18la水平也高于正常对照NSFs,并且外源性乳酸刺激能进一步诱导RASFs中H3K18la表达(图1L-P),证实乳酸可直接驱动组蛋白乳酸化修饰。这一结果确立了乳酸作为RA微环境中关键代谢信号分子,通过表观遗传重编程调控RASFs病理行为的起始环节。
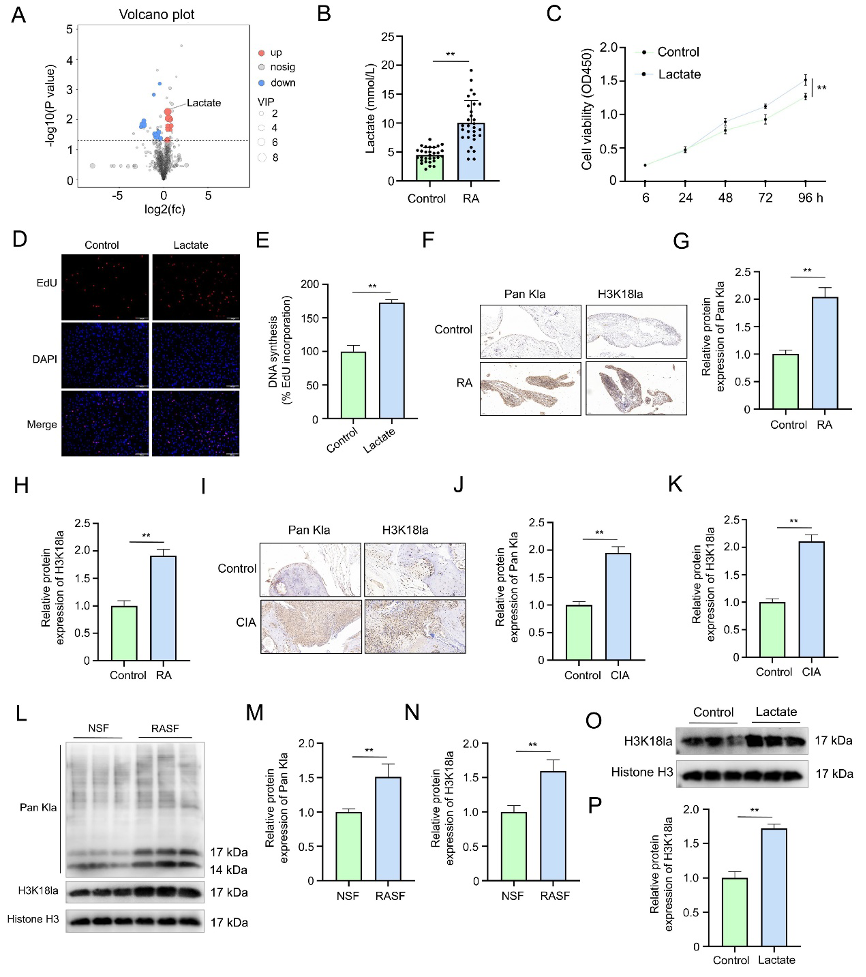
图1:RA患者滑液中升高的乳酸水平促进RASFs增殖。
(2)乳酸通过H3K18la修饰促进RASFs增殖,而METTL1是H3K18la的下游靶基因
为验证H3K18la的功能,采用siRNA敲低乳酸化writer酶P300,发现H3K18la可逆转乳酸诱导的RASFs增殖(图2A-C),证明H3K18la是乳酸促增殖效应的关键介质。为筛选H3K18la调控的下游基因,研究者对RASFs进行了H3K18la的ChIP-seq测序,并与RA滑膜组织差异表达RNA-seq结果进行相关性分析,筛选出8个候选基因(图2D-E)。
进一步乳酸刺激后,METTL1 mRNA上调最显著(图2F)。临床样本相关性分析显示,RA滑膜中METTL1表达与H3K18la水平呈正相关(图2G)。ChIP-qPCR证实H3K18la在METTL1启动子区显著富集,而抑制P300可降低这种富集(图2H)。
通过CRISPR-dCas9系统,靶向招募P300至METTL1启动子可特异性增强H3K18la修饰(图2I),而招募KRAB抑制结构域则降低修饰水平(图2J)。P300敲低同时阻断乳酸诱导的METTL1蛋白上调(图2K-L)。上述结果共同表明,乳酸诱导的H3K18la通过直接结合并激活METTL1的启动子,上调其表达。
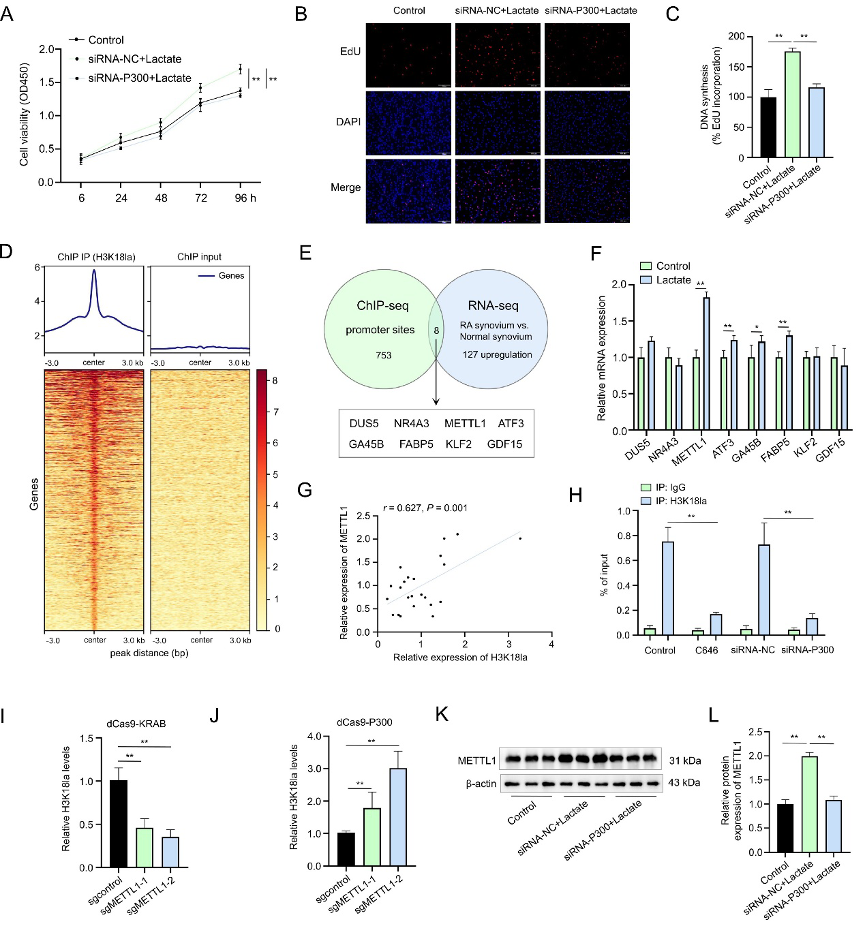
图2:乳酸通过H3K18la修饰促进RASFs增殖
(3)沉默METTL1抑制滑膜成纤维细胞(RASFs)增殖
在确认METTL1是H3K18la的下游靶点后,研究探究了METTL1在RA中的表达和功能。结果显示,与对照组相比,RA患者和CIA小鼠的滑膜组织中,整体m7G修饰水平和METTL1蛋白表达均显著升高(图3A-E)。在细胞水平,RASFs中的METTL1 mRNA和蛋白水平也高于NSFs(图3F-H)。功能上,使用siRNA敲低METTL1后(图3I-J),RASFs的增殖能力被显著抑制(图3K-M)。该结果证实METTL1介导的m7G修饰是维持RASFs快速增殖的关键调控因子,且该效应不依赖于乳酸刺激。
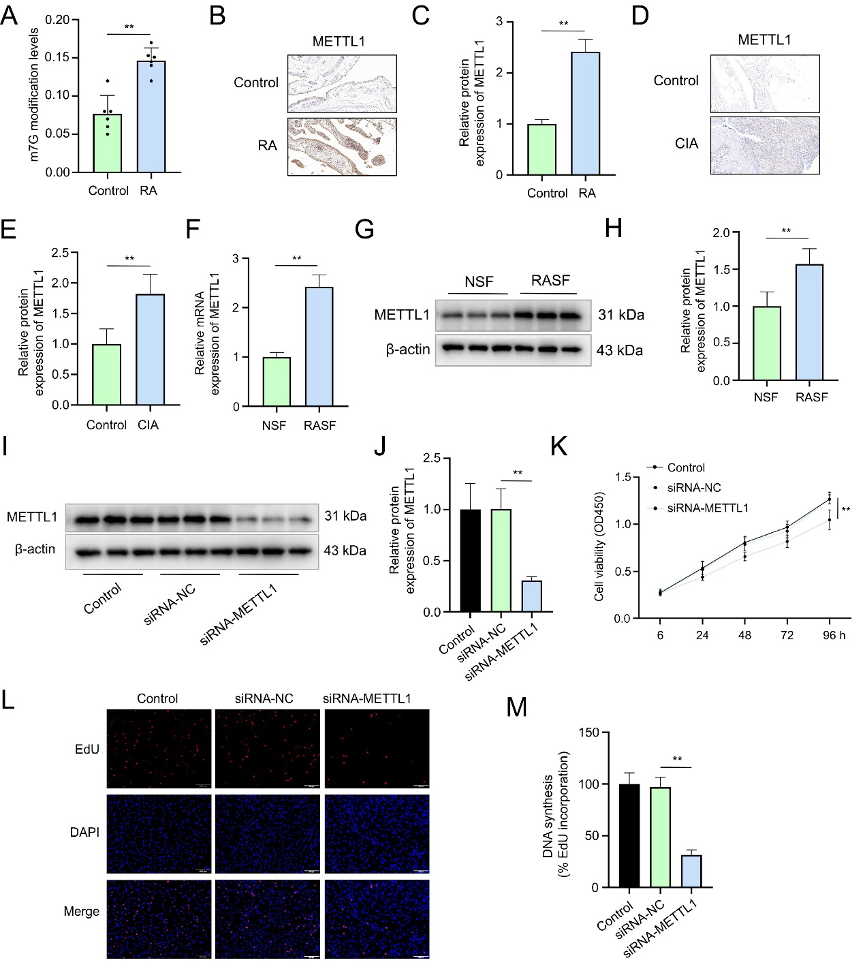
图3:METTL1沉默对RASFs增殖的功能作用
(4)METTL1沉默消除乳酸诱导的铁死亡抑制并进一步减少RASFs增殖
为探索METTL1促增殖的下游机制,研究者对RA与对照滑膜组织进行了mRNA-seq,鉴定出2118个差异表达基因(1,146上调/972下调)(图4A),并通过GSEA分析发现,METTL1低表达与铁死亡相关基因集富集相关(图4B),提示METTL1可能抑制铁死亡。
已知铁死亡是RASFs的一种潜在死亡方式。Erastin诱导实验证实,乳酸预处理可逆转铁死亡特征(脂质过氧化、ROS升高、线粒体萎缩),而METTL1敲低则恢复细胞对铁死亡的敏感性:线粒体膜电位下降(图4C-D)、MDA水平回升(图4E)、脂质ROS增加(图4F)、电镜显示线粒体出现典型铁死亡形态(图4G)。功能上,METTL1沉默不仅阻断乳酸的促增殖作用,反而使RASFs生长速率低于基础水平(图4H-J),这表明METTL1介导了乳酸赋予RASFs的铁死亡抵抗性,从而支持其持续增殖。该结果将METTL1功能从转录后调控延伸至细胞死亡方式调控,揭示了代谢-表观遗传-细胞命运交叉调控的新角度。
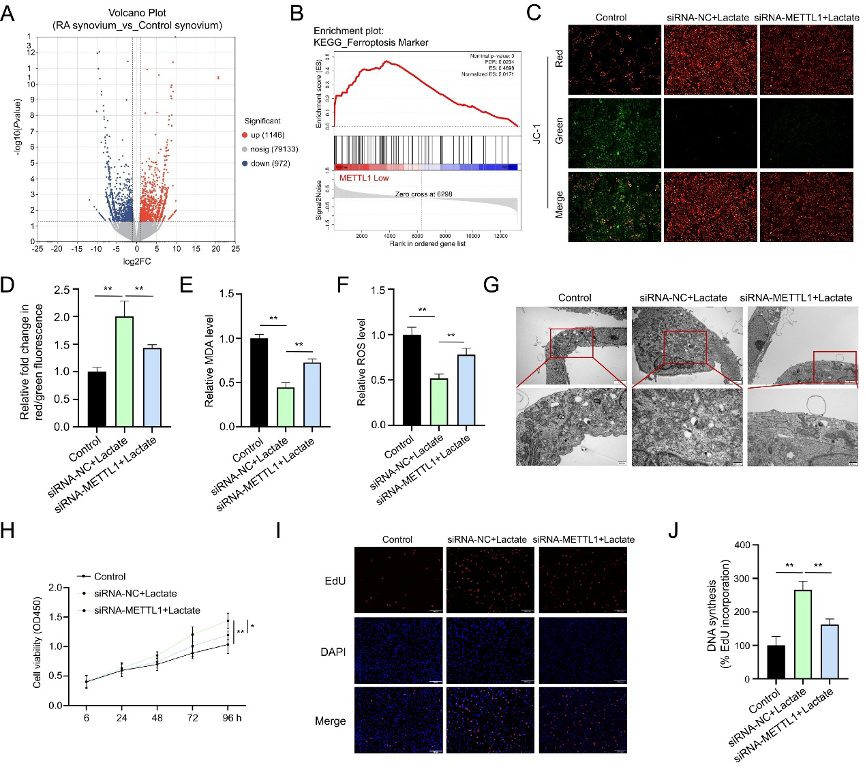
图4:沉默METTL1对乳酸刺激的RASFs铁死亡和增殖的作用
(5)NeuroD1是RASFs中METTL1介导的m7G修饰靶基因
研究人员对RASFs和NSFs进行了m7G MeRIP-seq与RNA-seq联合分析(图5A),共筛选鉴定出7个高甲基化且高表达的候选基因(图5B)。在扩大临床样本中验证后,NeuroD1的m7G修饰水平和mRNA表达上调最显著(图5C-D)。m7G RIP-qPCR显示,敲低METTL1能显著降低NeuroD1 mRNA上的m7G修饰水平(图5E),同时,METTL1敲低也降低了NeuroD1的mRNA和蛋白表达(图5F)。
双荧光素酶报告基因实验构建NeuroD1 5'UTR野生型与m7G motif突变体质粒,证实METTL1直接调控其修饰(图5G-H)。RNA稳定性实验和MS2拴系实验进一步证明,METTL1通过其m7G甲基转移酶活性(而非催化失活突变体)来增强NeuroD1 mRNA稳定性(图5I,J)。
临床样本也证实NeuroD1在RA患者和CIA小鼠滑膜组织中高表达(图5K-M),RASFs中表达显著高于NSFs(图5N-O)。生物信息学分析预测NeuroD1可能调控多个铁死亡相关基因,实验验证敲低NeuroD1能显著下调GPX4的表达(图5P-Q)。最后,通过构建不同长度的GPX4启动子报告基因,证实NeuroD1能直接结合并转录激活GPX4启动子(图5R-T)。上述结果通过MeRIP-seq技术精确锁定NeuroD1为METTL1下游效应分子,阐明了m7G修饰通过增强mRNA稳定性调控转录因子表达的分子机制。
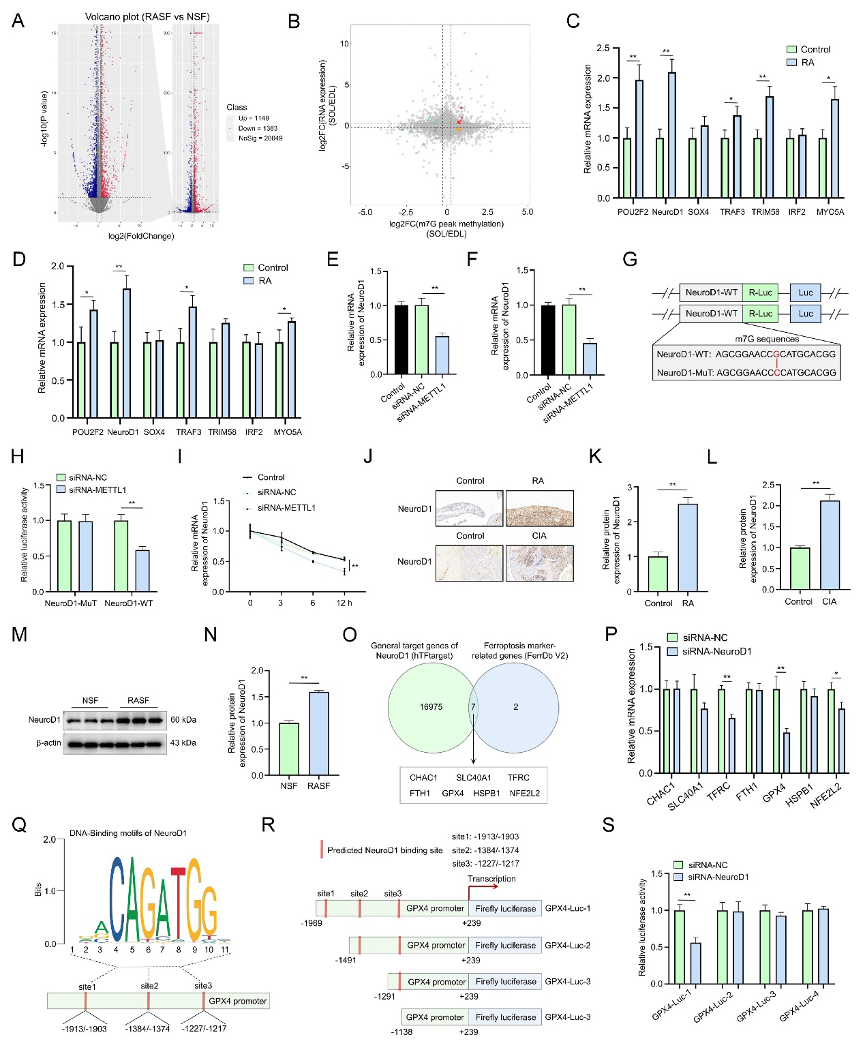
图5:NeuroD1是RASFs中METTL1依赖的m7G甲基化底物
(6)NeuroD1过表达部分逆转METTL1沉默对铁死亡和RASFs增殖的抑制效应
为验证NeuroD1是否介导METTL1功能,在METTL1敲低基础上过表达NeuroD1。挽救实验显示,NeuroD1过表达可恢复线粒体膜电位(图6A-B)、降低MDA和ROS水平(图6C-D)、改善线粒体形态异常(图6E),表明其可以部分挽救因METTL1缺失导致的铁死亡。
增殖功能方面,NeuroD1过表达使METTL1沉默细胞的生长速率回升30%(图6F),EdU阳性率从10%恢复至22%(图6G-H)。该结果证实NeuroD1是METTL1-m7G轴的关键调控因子,位于METTL1下游调控铁死亡抵抗和细胞增殖,构成完整的"METTL1→NeuroD1→GPX4"信号链。
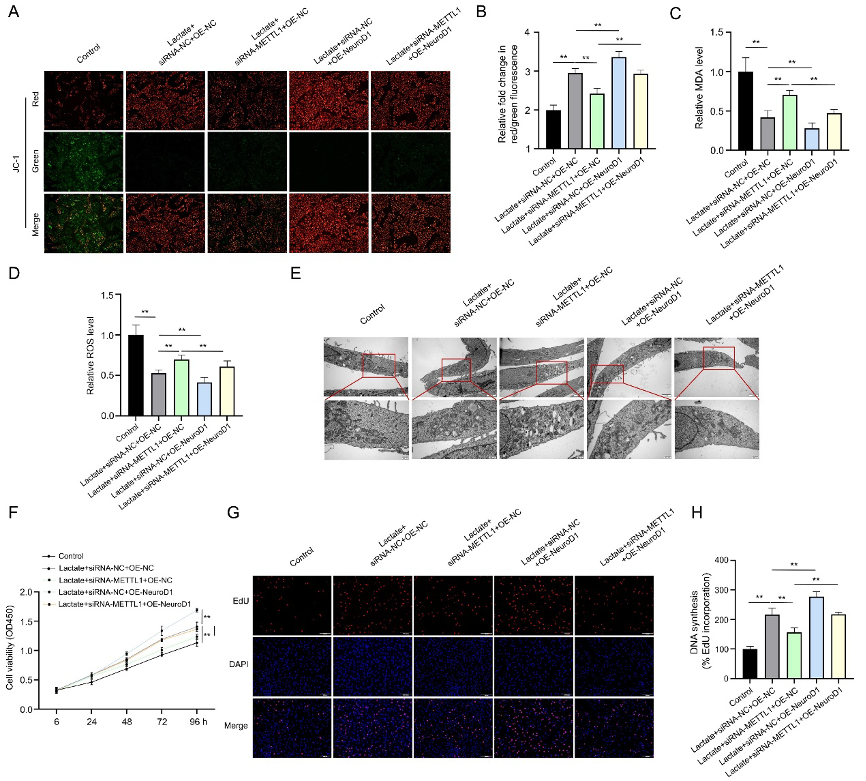
图6:NeuroD1过表达部分逆转了METTL1沉默对铁凋亡和RASF增殖的作用
(7)局部敲低METTL1或NeuroD1减轻CIA模型关节炎严重程度
最后研究在CIA小鼠模型中进行了体内功能验证。通过关节内注射携带shMETTL1/shNeuroD1慢病毒(图7A),局部敲低这两个基因。结果显示,与对照组相比,敲低METTL1或NeuroD1小鼠体重下降趋势缓解,且能显著改善小鼠的关节炎临床评分(图7B-C)。组织学染色显示,处理组的关节滑膜增生、炎症浸润和软骨破坏等病理变化显著减轻(图7D-H)。免疫组化分析显示,处理组关节滑膜中H3K18la、METTL1、NeuroD1和GPX4的表达也相应降低(图7I-L)。其疗效与阳性药物甲氨蝶呤(MTX)相当。这有力证明了靶向“乳酸-H3K18la-METTL1-NeuroD1”轴在体内具有治疗RA的潜力,局部干预即可产生系统性关节炎改善效果。
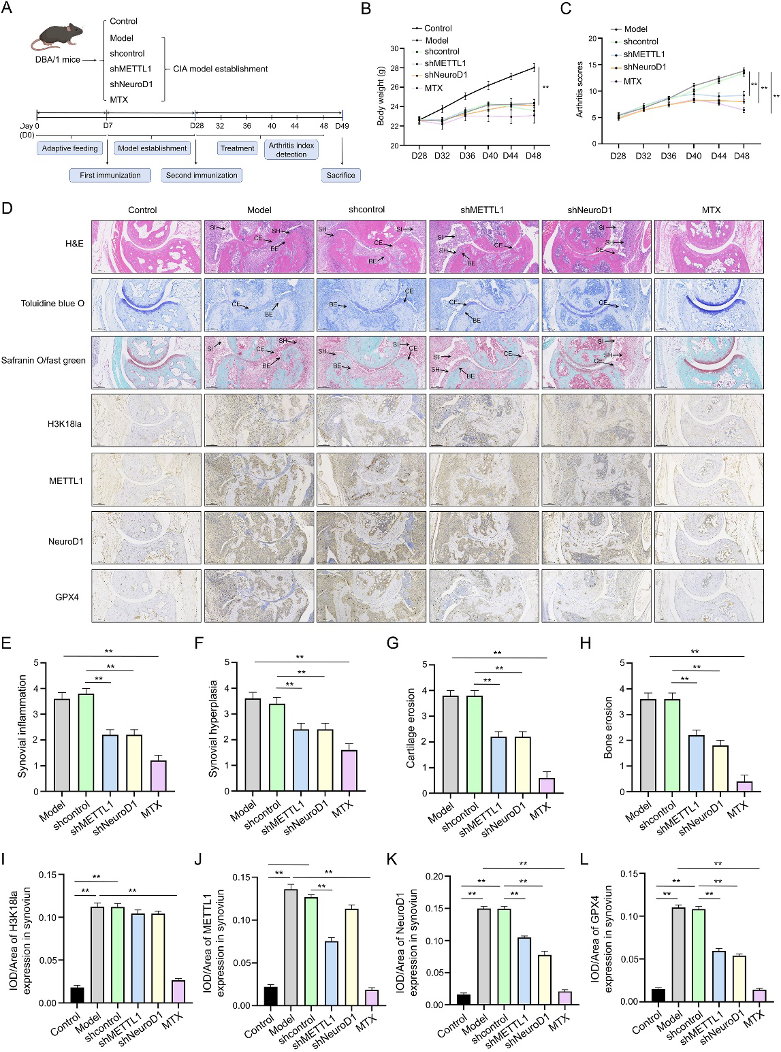
图7:关节内注射METTL1或NeuroD1 shRNA对CIA小鼠关节炎严重程度的作用
结论和启示
本研究揭示,RA滑膜微环境中积累的乳酸,通过诱导H3K18la修饰上调METTL1表达,METTL1进而介导NeuroD1 mRNA的m7G修饰并增强其稳定性,导致NeuroD1蛋白积累。进一步,NeuroD1作为转录因子激活GPX4表达,抑制脂质过氧化,最终介导RASFs铁死亡抵抗性,促进其异常增殖和RA进展。
m7G MeRIP-seq与多组学数据整合策略,绘制了RASFs中m7G修饰图谱,并与ChIP-seq(H3K18la)、RNA-seq进行多组学关联分析,从"染色质状态-修饰靶标-表达变化"角度验证METTL1-NeuroD1轴。这种多组学交叉验证策略显著提高了靶点筛选的可靠性,避免了单一组学可能产生的假阳性,展现了表观多组学研究在解析复杂疾病调控网络中的独特优势。
参考文献:
Xu Y, Liu W, Zai Z, Qian X, Hu W, Peng X, Chen F. METTL3 increases ferroptosis resistance to facilitate the tumor-like features of rheumatoid arthritis synovial fibroblasts through enhancing SLC7A11 mRNA stability in an m6A-IGF2BP2-dependent manner. Int J Biol Macromol. 2025 Jul 5:145698. doi: 10.1016/j.ijbiomac.2025.145698.