
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
近日,南方科技大学前沿生物技术研究院/医学院2022级博士研究生许超、王梦鸽等为第一作者,朱健康院士(现履新澳门科技大学第五任校长)和刘朋朋教授为共同通讯作者,在《The Innovation》期刊上发表了题为“mRNA-engineered CRISPR-Cas epigenetic editors enable durable and efficient gene silencing in vivo”的科研成果,开发了名为“CRISPR OFF-EE”的CRISPR-Cas表观遗传编辑器新型基因沉默平台。该研究通过AI辅助优化mRNA序列,结合脂质纳米颗粒(LNP)递送系统,将失活型Cas蛋白(dSpCas9/dSF01)与DNA甲基转移酶(DNMT3A-3L)及转录抑制结构域(KRAB)融合形成的表观编辑器mRNA递送至小鼠肝脏,单次注射即可实现小鼠体内长达180天的 PCSK9 基因沉默。
该研究通过系统性的mRNA工程(V2优化)、LNP配方筛选以及多组学分析(WGBS和RNA-seq),证明该策略具有高特异性、高安全性和长效效应,为靶向PCSK9的高血脂类慢性病表观遗传治疗方案提供了“一次注射,长期受益”的关键临床应用前证据。易基因科技为本研究提供了关键的全基因组DNA甲基化测序(WGBS)技术服务支撑,证实沉默效应与甲基化强度直接相关,为长效机制提供分子证据。

英文标题:mRNA-engineered CRISPR-Cas epigenetic editors enable durable and efficient gene silencing in vivo
中文标题:mRNA结构优化的CRISPR-Cas表观遗传编辑器实现体内长效基因沉默
发表时间:2025年10月27日
发表期刊:The Innovation
影响因子:五年影响因子40.2/Q1
技术平台:WGBS、RNA-seq等(易基因金牌技术)
作者单位:南方科技大学
Doi:10.1016/j.xinn.2025.101151
可编程表观遗传编辑器(EEs)能够在不改变DNA序列的情况下实现基因表达的长期调控,具有远大的治疗前景,然而当前基于CRISPR的表观基因组编辑器在临床转化方向面临重大挑战。本研究利用化脓性链球菌Cas9(SpCas9)、内含肽分割的SpCas9或更小的Cas-SF01(Cas12i3变体),对通过mRNA递送的表观遗传编辑器(CRISPR OFF-EE)进行合理设计与工程化构建,结合mRNA结构优化和脂质纳米颗粒(LNP)递送,单次静脉注射优化的OFF-EE V2 mRNA以及靶向小鼠Pcsk9的向导RNA(gRNAs),导致循环PCSK9水平降低约83.2%,相应的低密度脂蛋白胆固醇(LDL-C)水平降低约51.4%,效果持续至少180天。与基于SpCas9对应编辑器相比,基于SF01的编辑器显示出更高特异性,脱靶效应更少。此外,优化的LNP制剂还表现出良好安全性和肝脏靶向活性。这些发现建立了一个强大且多功能的平台,为基于瞬时递送、工程化mRNA编辑器的精确且长效的表观遗传沉默的体内治疗策略提供了有力证据。
研究亮点
AI辅助的表观遗传编辑器mRNA工程化
通过LNP递送实现Pcsk9的体内长效沉默
SF01-OFF-EE具有更优特异性谱,脱靶效应更少
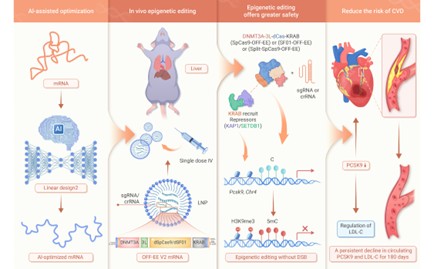
图形摘要
易小结
本研究证明瞬时的mRNA/LNP递送系统可实现与AAV或质粒DNA相当的超长效基因沉默效果,规避了病毒载体整合与长期表达的安全风险。为慢性病提供了“一针疗法”的潜在替代方案,具有革命性提升。
此外,研究系统建立了基于WGBS(易基因金牌技术)的全基因组脱靶效应评价金标准,为表观编辑技术的临床转化安全性评估提供了方法学基础。
易基因相关拓展性产品案例
l 项目文章|Sci Adv:WGBS+ChIP-seq揭示DNA甲基化在异基因造血干细胞移植后延迟血小板恢复中的关键作用
l 项目文章|JAR (IF13):西农陈玉林团队多组学分析揭示绵羊早期胚胎发育的分子与表观遗传调控机制
l 项目文章 | 植入前胚胎的全基因组DNA甲基化和转录组分析揭示水牛胚胎基因组激活进展
l 项目文章|微量WGBS+ACE-seq揭示卵巢早衰的人卵丘细胞DNA甲基化与羟甲基化表观基因组图谱
研究方法
(1)表观遗传编辑器构建
构建基于dSpCas9和dSF01的CRISPR OFF-EE,融合DNMT3A-3L和KRAB效应因子。
(2)mRNA工程与优化
V1到V2的优化:通过AI辅助密码子优化、优化5’和3’UTR、改进核定位信号(NLS)、采用split poly(A)尾策略,开发“superfolder” V2 mRNA,提高翻译效率、稳定性和核定位功能,同时减少免疫原性dsRNA副产物。
Split系统设计:开发基于内含肽(intein)的573-split-SpCas9-OFF-EE和713-split-SpCas9-OFF-EE,以解决大分子编辑器递送难题。
(3)LNP递送系统开发与筛选
合成8种不同组分的LNP配方(LNP1-LNP8),通过体内筛选(以PCSK9敲低和肝脏编辑效率为指标)选出最优肝脏靶向配方LNP8,并验证其良好的生物分布和安全性。
(4)细胞与动物模型
细胞模型:使用Gapdh-Snrpn-GFP报告细胞系、CD29/CD81/CD151内源基因沉默模型以及构建的Hepa1-6 Pcsk9-IRES-EGFP报告细胞系进行体外筛选和功能验证。
动物模型:使用野生型C57BL/6小鼠进行体内疗效、长效性和安全性评估。
(5)分子机制研究寄验证:
全基因组重亚硫酸盐测序(WGBS):在全基因组范围内精确检测CpG位点的DNA甲基化水平变化,评估表观遗传编辑特异性和整体作用,鉴定差异甲基化区域(DMRs),确认在Pcsk9位点的靶向高甲基化,并排除全基因组范围的异常甲基化。
RNA测序(RNA-seq):分析转录组变化,鉴定差异表达基因(DEGs),确认Pcsk9转录沉默并评估脱靶转录效应。
CUT&Tag-qPCR:分析Pcsk9启动子特定基因组位点的H3K9me3修饰和FLAG标记的dCas9蛋白富集情况。
靶向扩增子深度测序:评估特定基因位点的编辑效率。
(6)功能检测:
流式细胞术:检测报告基因(GFP)或细胞表面标志物(CD151)的沉默效率。
ELISA和血液生化:定量检测小鼠血清中PCSK9蛋白、LDL-C及肝肾功能指标。
(7)安全性评估
组织病理学(H&E染色)、血清炎症因子(TNF-α, IL-6, IFN-α, IFN-β)检测、以及通过WGBS和RNA-seq全面评估脱靶效应。
结果图形
(1)通过质粒递送在哺乳动物细胞中初步验证CRISPR OFF-EEs功能
研究首先在HEK293T细胞来源的Gapdh-Snrpn-GFP报告系统中验证两种质粒型表观编辑器功能(图1)。该系统将GFP表达置于甲基化敏感的Snrpn启动子调控下,当启动子被甲基化时GFP沉默。团队构建了dSpCas9-OFF-EE与dSF01-OFF-EE两种融合蛋白,N端连接DNMT3A-3L甲基转移酶复合体,C端融合KRAB转录抑制域。转染30天后流式分析显示,Snrpn靶向的sgRNA/crRNA分别使63.0%(SpCas9)和60.4%(SF01)细胞GFP沉默(图1B-C)。靶向亚硫酸盐测序(图1D)证实Snrpn启动子区域CpG位点甲基化显著增加,而邻近Gapdh启动子甲基化未变,证明靶向特异性。在CD151内源基因沉默实验中(图1E-F),两种编辑器分别实现63.3%和32.1%的蛋白敲低,且均伴随CD151启动子CpG岛高甲基化。这些数据确立了质粒递送OFF-EEs可在体外建立可遗传的、甲基化依赖性基因沉默。
图1:CRISPR OFF-EEs在HEK293T细胞中对Gapdh-Snrpn-GFP报告基因和内源性CD151进行表观遗传沉默
(2)开发基于mRNA的优化EE平台
为实现更安全、瞬时的体内递送,研究团队转向mRNA/LNP系统。初始的未优化V1 mRNA(T7启动子、β-globin UTR)在体内效果不佳。因此研究团队对mRNA进行全面工程优化,通过AI辅助全面重构为V2版本(图2A)。
优化包括:AI辅助密码子优化、优化UTR、改进NLS、采用split poly(A)尾等。这些优化显著提升了编辑器蛋白的核定位、mRNA的翻译效率和稳定性,并减少免疫原性dsRNA杂质。尽管进行大量修饰,封装V2 mRNA的LNP仍能保持与V1相似的粒径和分散性,为后续高效的体内递送奠定了基础。
图2:优化SpCas9-OFF和SF01-OFF表观编辑器mRNA以实现长效基因沉默
(3)优化的OFF-EE V2 mRNA EEs在培养细胞中介导长效基因沉默
在Gapdh-Snrpn-GFP报告细胞中,V2 mRNA电转后3周,SpCas9-OFF-EE V2与SF01-OFF-EE V2分别实现81.2%和44.3%的GFP沉默(图2B-C),显著优于V1版本。靶向亚硫酸盐测序显示V2处理组Snrpn启动子CpG甲基化率较V1组提升30-50%。在HEK293T细胞中,靶向CD29、CD81、CD151三个内源基因沉默实验显示,SpCas9-OFF-EE V2的沉默效率显著高于V1(图2B-C),且V2诱导的靶基因启动子甲基化水平全面超过V1。上述实验数据证明,mRNA全面优化极大增强了其编辑效能与长效性,后续实验均采用V2版本。
(4)Pcsk9表观遗传沉默的gRNA体外筛选与优化
为精准靶向Pcsk9,团队构建了Hepa1-6 Pcsk9-IRES-EGFP报告细胞系(图2D),使EGFP表达与内源Pcsk9转录偶联。通过电转V2 mRNA与41条crRNA(SF01)或10条sgRNA(SpCas9)覆盖TSS区域±700 bp范围(图2E),流式筛选结合甲基化分析锁定最优gRNA。结果显示SpCas9的sgRNA3/sgRNA4(邻近TSS)及SF01的AS-cr7+S-cr14组合在7天与21天时EGFP沉默效率最高(图2F-G),且与Pcsk9启动子CpG甲基化水平呈正相关(图2H-I)。多gRNA组合(双份或三份)较单条gRNA沉默效果提升20-40%(图3A-D)。最终,根据沉默效率、长效性和脱靶效应,筛选出SpCas9-OFF-EE的Na-sgRNA + sgRNA-4组合和SF01-OFF-EE的AS-cr7 + S-cr14组合作为后续体内研究的先导候选。并在野生型Hepa1-6细胞中验证,21天后培养基PCSK9蛋白水平显著下降(图3E),证实其强效沉默能力。
图3:小鼠肝细胞中Pcsk9靶向编辑器的体外筛选与多组学特异性分析
(A-B)使用SpCas9-OFF-EE与多重sgRNAs(A)或SF01-OFF-EE与多重crRNAs(B)处理后21天,报告细胞中EGFP沉默效果的评估。
(C-D)对应(C)和(D)处理中Pcsk9启动子处CpG甲基化的定量分析。
(E)ELISA检测不同编辑器处理Hepa1-6细胞21天后分泌的PCSK9蛋白水平。
(F)WGBS检测的全基因组CpG甲基化水平柱状图,显示各处理组间无显著全局性变化(n=3)。
(G)不同编辑器构建处理的Hepa1-6细胞中Pcsk9位点的CpG甲基化谱,显示CpG岛发生靶向高甲基化。
(H-I)WGBS比较SpCas9-OFF-EE(H)或SF01-OFF-EE(I)处理细胞与模拟对照组的全基因组甲基化变化曼哈顿图。Pcsk9差异甲基化区域(DMR)内的差异甲基化CpG(DMC)以红色显示。
(J)RNA-seq火山图显示SpCas9-OFF-EE(左)和SF01-OFF-EE(右)处理后的DEGs。
(K-L)SpCas9-OFF-EE(K)和SF01-OFF-EE(L)的DMR甲基化变化与基因表达变化的相关性散点图。
(5)靶向Pcsk9的表观基因组编辑器在小鼠肝细胞中的综合特异性分析
为严格评估编辑器构型的特异性,研究在Hepa1-6细胞中进行了全基因组范围的WGBS和RNA-seq多组学分析。结果显示,所有四种编辑器(SpCas9-OFF-EE, SF01-OFF-EE, 573-split-, 713-split-SpCas9-OFF-EE)均能在Pcsk9 TSS区域诱导强烈且特异的CpG高甲基化(图3G)。WGBS分析表明,与模拟对照组相比,编辑器处理细胞的全局CpG甲基化水平基本未变(图3F)。差异甲基化区域(DMR)分析证实,最显著和深远的甲基化变化高度特异性地集中在靶向的Pcsk9位点(图3H-I)。RNA-seq显示Pcsk9 mRNA水平显著降低(图3J)。将DMR与差异表达基因(DEG)进行关联分析发现,SF01-OFF-EE引起的与DMR相关的脱靶转录变化(15个基因)少于SpCas9-OFF-EE(60个基因)(图3K-L),提示SF01编辑器可能具有更高的特异性。这些多组学数据共同证明,优化的编辑器能实现高度靶向性的表观遗传修饰,且SF01系统可能具有更优的特异性谱。
图S3:Pcsk9经Split-SpCas9-OFF-EEs表观遗传沉默后Pcsk9的靶标特异性转录下调
(A-B) 通过WGBS检测的全基因组甲基化变化曼哈顿图,比较经573-Split-SpCas9-OFF-EE/sgRNAs处理细胞vs仅含效应元件对照组 (A)、713-Split-SpCas9-OFF-EE/sgRNAs处理细胞vs仅含效应元件对照组 (B)。
(C) RNA-seq分析火山图显示模拟处理细胞与经573-Split-SpCas9-OFF-EE/sgRNAs(左)或713-Split-SpCas9-OFF-EE/sgRNAs(右)处理细胞之间的差异基因表达。
(D-E) 散点图展示WGBS中DMR的甲基化差异(y轴)与RNA-seq中基因表达(x轴)的相关性。
(6)LNP介导表观基因组编辑器递送后实现Pcsk9的高效体内沉默
研究首先通过体内筛选从8种LNP配方中选出了肝脏递送效率最高的LNP8(图4A-B)。生物分布实验证实LNP8具有肝脏强趋向性。将优化的SpCas9-OFF-EE V2或SF01-OFF-EE V2 mRNA与对应gRNA封装进LNP8,单次静脉注射给小鼠。结果显示,两种编辑器均能剂量依赖性地降低血清PCSK9和LDL-C水平(图4C-D)。在最高剂量(3.0mg/kg)下,SpCas9-OFF-EE V2、SF01-OFF-EE V2以及两种split-SpCas9-OFF-EE均能显著降低PCSK9和LDL-C,其中SpCas9-OFF-EE V2效果最强(图4E-F)。这些结果证明LNP-mRNA递送OFF-EE可在体内快速、长效实现靶基因沉默治疗。
图4:通过LNP介导的mRNA递送在小鼠体内实现Pcsk9的高效表观遗传沉默
(7)靶向Pcsk9的OFF-EEs在体内的特异性图谱和长效沉默功能
为评估体内特异性和长效性,对小鼠肝脏组织进行WGBS和RNA-seq分析。WGBS再次验证其在Pcsk9位点存在高度靶向性的CpG高甲基化,且是全基因组范围内最显著DMR(图5A、C)。RNA-seq分析证实Pcsk9是下调最显著基因(图5B、D、F)。DMR与DEG的关联分析显示,SF01-OFF-EE引起的脱靶转录变化少于SpCas9-OFF-EE(图5B、D),与细胞实验结果一致,进一步支持SF01编辑器的高特异性。重要的是,尽管靶向Pcsk9的甲基化水平增加,但全基因组CpG甲基化水平在各处理组间基本保持不变(图5E),证明其编辑高特异性。GO分析显示,差异表达基因显著富集在胆固醇和类固醇代谢通路(图5G),与Pcsk9沉默的预期生物学效应一致。
为验证沉默长效性,团队对C57BL/6小鼠进行了180天长期追踪(图6A)。结果显示,单次注射后,循环PCSK9和LDL-C水平的抑制效果可稳定持续至少180天(图6B-C)。WGBS分析肝脏组织显示,在注射后30天和180天,Pcsk9位点的CpG甲基化均得到维持(图6D-E)。上述研究结果从表观遗传机制上解释了疗效的持续性,有望实现“一次注射,长期受益”的长效治疗目标。
图5:小鼠肝脏中Pcsk9沉默的综合体内特异性分析
(A、C) 肝脏组织WGBS曼哈顿图比较了经SpCas9-OFF-EE (A) 或 SF01-OFF-EE (C) 处理组小鼠与对照组。最显著DMR位于Pcsk9位点(红框)。
(B、D) SpCas9-OFF-EE (B) 和 SF01-OFF-EE (D) 的DMR与DEG的相关性分析散点图。Pcsk9(蓝点)是共有脱靶基因。
(E) 不同处理组肝脏组织的整体CpG甲基化水平未发生改变。
(F) 与对照组相比,肝脏组织RNA-seq火山图显示经SpCas9-OFF-EE(左)和SF01-OFF-EE(右)处理的小鼠中Pcsk9为最显著下调基因。
(G) 对肝脏中RNA-seq鉴定出的DEG进行GO富集分析,显示两组处理均显著富集胆固醇和类固醇代谢通路,与Pcsk9沉默效应一致。
图6:Pcsk9基因在体内实现长达180天的持久沉默
(A) 体内长效性研究设计示意图。C57BL/6小鼠接受单次静脉注射LNP配制的编辑器,在指定的时间点采集血液和肝脏组织以供分析。
(B-C) 循环PCSK9(B)和LDL-C(C)水平的持续180天时序性分析。
(D-E) 注射后第30天(D)和第180天(E)肝脏组织中Pcsk9位点WGBS分析图谱,显示与对照组相比,编辑器处理组在启动子CpG岛(橙色框)处呈现强效且持续的CpG高甲基化。
(8)LNP介导的表观基因组编辑器体内递送的安全性评估
研究对治疗的安全性进行了全面评估。组织病理学分析显示主要器官无异常。血清肝肾功能指标(ALT, AST, CR, urea)在编辑器处理组和对照组间无显著差异(图7A-D)。炎症因子检测显示,LNP-mRNA注射后仅引起短暂、轻微的先天免疫反应,并在24小时内恢复至基线。体内编辑分布显示,编辑器活性主要局限于肝脏,在其他器官(除脾脏有微弱信号外)未检测到编辑(图7E)。最重要的是,通过WGBS对多种组织(心、肝、脾、肺、肾)的全基因组DNA甲基化测序分析表明,仅在肝脏中检测到Pcsk9启动子的特异性高甲基化,在其他非肝组织中未发现变化(图7F),这些数据共同支持LNP-OFF-EE平台具有良好的体内安全性与组织特异性,符合临床转化要求。
图7:LNP介导的编辑器系统体内递送的安全性评估
结论和启示
本研究证明,通过AI辅助的mRNA工程和优化的LNP递送,单次注射CRISPR-Cas表观遗传编辑器mRNA,即可在小鼠体内实现长达180天的对PCSK9基因的特异性、长效沉默,并伴随有益的生理指标(LDL-C等)长期改善。这为开发“一次治疗,长期获益”的慢性病疗法奠定了坚实的技术基础。该研究建立了一个高效、安全、可编程的表观遗传编辑平台,不仅为PCSK9相关疾病,也为其他需要长期调控基因表达的疾病提供了新的治疗策略。
易基因提供的WGBS技术支撑在本研究中的重要核心作用
靶点特异性确证:WGBS精确量化Pcsk9启动子CpG岛甲基化水平,30天与180天数据(图6D-E)证实沉默效应与甲基化强度直接相关,为长效机制提供分子证据。
全基因组脱靶筛查:DMR分析显示,在SpCas9与SF01处理组中分别仅鉴定出60与15个脱靶基因(图3K-L),证明平台高保真度。
整体甲基化监测:编辑器处理后全基因组CpG甲基化水平变化不显著(图3F、图5E),排除大规模表观干扰风险,这是传统靶向测序无法提供的关键安全性证据。
比较编辑器性能:WGBS横向对比SpCas9、SF01及split-SpCas9变体(图3G, S3A-B),揭示SF01脱靶率最低,为临床候选物选择提供数据驱动依据。
体内-体外一致性验证:Hepa1-6细胞的WGBS与体内肝脏WGBS结果高度吻合,但体内特异性更优,警示细胞模型局限性,强调原代组织WGBS评价的必要性。
未来,在基于表观遗传编辑的基因治疗研究中,WGBS可以作为一项必做的核心评估项目。WGBS不仅能验证编辑是否按预期工作,更是评估其精准性(特异性)和安全性(整体影响)的黄金标准。未来研究在开发新的表观遗传编辑器、优化gRNA设计、或测试不同递送系统时,都应借助WGBS来全面、无偏地评估其在全基因组范围内的甲基化编辑效果,确保治疗策略的精准与安全。
参考文献:Xu, Chao & Zeng, Chen & Wang, Mengge & Wei, Xiaofei & Song, Minglei & Liu, Xiaoyi & Wang, Weiping & Chen, Qitong & Ji, Xingkun & Luo, Pengyu & Ma, Liyong & Sun, Yan & Gou, Hanlin & Zhu, Zeyao & Li, Xiaohua & Lv, Yu-xuan & Liu, Pengpeng & Zhu, Jian-Kang. (2025). mRNA-Engineered CRISPR-Cas epigenetic editors enable durable and efficient gene silencing in Vivo. The Innovation. 101151. 10.1016/j.xinn.2025.101151.